


Introduction : Des notions de base sur les solutions
a.Un peu de vocabulaire
Pour préparer une solution par disolution, il faut dissoudre un soluté dans un solvant.
Le soluté est le "corps" dissous dans le solvant, et le solvant est le liquide dans lequel on dissout le soluté.
Si le solvant est de l'eau, la solution est aqueuse.
Exemple:
- Une solution aqueuse de sulfate de cuivre à pour soluté : sulfate de cuivre et pour solvant : eau
- Si on mélange du diiode dans l'alcool on obtient une solution de diiode.
b. La concentration massique
Si j'ai 5g de sel dans 1L de solution, j'obtiens une solution d'eau salée de concentration massique (notée Cm) 5g/L.
Et si je n'ai pas un volume (noté V) d'1 litre ? → Cm représente la proportion entre m et V, on a donc la relation:
- Cm = m / V ou m = Cm x V
- Cm la concentration massique en g/L.
- V est le volume de solution (et pas de solvant!) en litre (L).
- m est la masse de soluté en gramme (g).
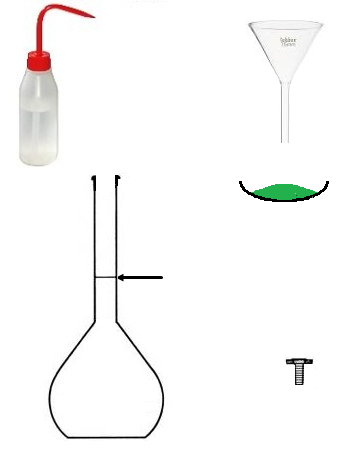
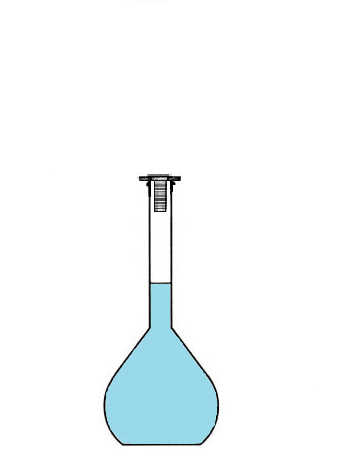
c. Préparer une solution avec une fiole jaugée?
Si je mélange 10g de sel et 100mL d'eau, j'obtiens une solution de volume 100mL.
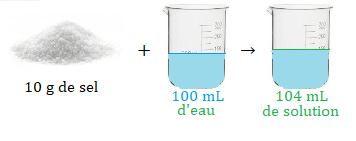
Vous avez raison 😎, même dissout, les 10g de sel ont un volume.
On obtient un volume de solution supérieur à 100 mL.
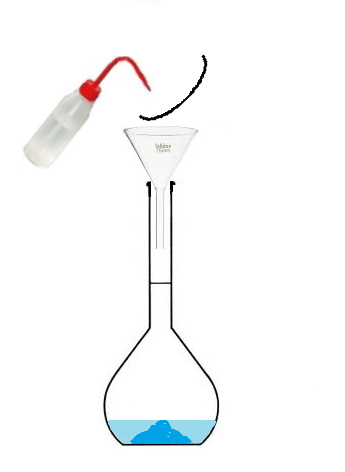
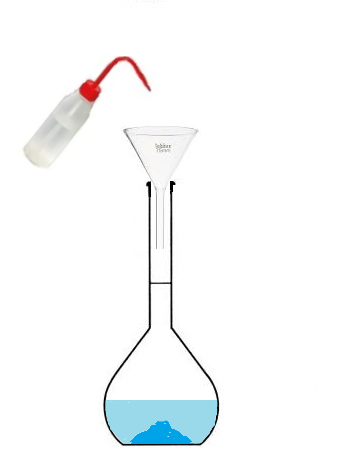
Conclusion : Pour préparer une solution de volume 100 mL, on ne va pas utiliser 100mL de solvant
mais on va utiliser une fiole jaugée que l'on va remplir jusqu'au trait de jauge.
On obtient un volume de solution supérieur à 100 mL.
Conclusion : Pour préparer une solution de volume 100 mL, on ne va pas utiliser 100mL de solvant
mais on va utiliser une fiole jaugée que l'on va remplir jusqu'au trait de jauge.

Quelle fiole jaugée choisir si on veut une solution de volume 150 mL ?
Il faut choisir une fiole de 250 mL, puis prélever un volume de 150mL,
avec par exemple une éprouvette graduée.
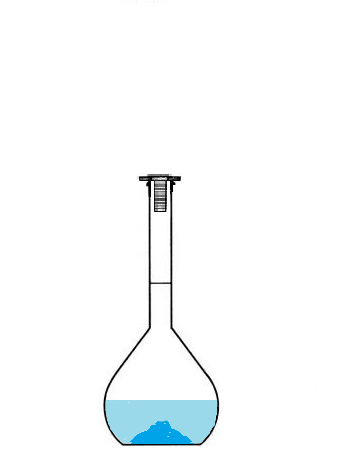
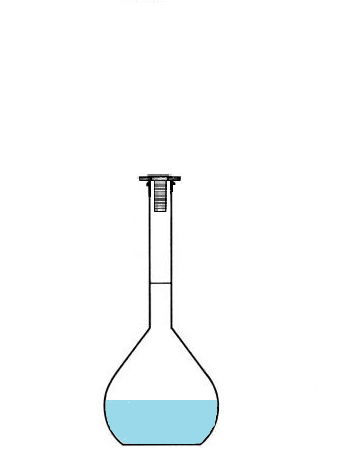
Le volume de solution préparée correspond forcément au volume de la fiole jaugée,
puisqu'on va la remplir jusqu'au trait de jauge.
avec par exemple une éprouvette graduée.
Le volume de solution préparée correspond forcément au volume de la fiole jaugée,
puisqu'on va la remplir jusqu'au trait de jauge.
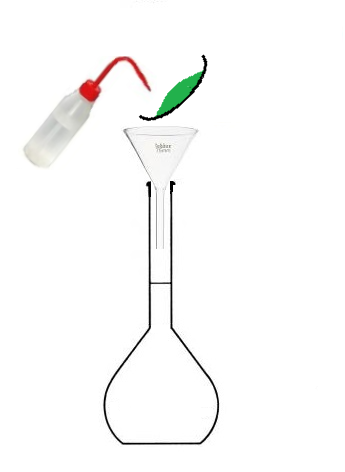
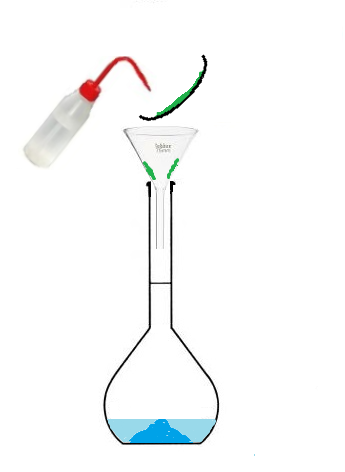
d. Savoir préparer une solution par dissolution
On vous propose une simulation, dans laquelle vous allez préparer une solution de sulfate de cuivre (de concentration aléatoire).
Voici les étapes:
- 1.Calculer la masse de soluté
- 2.liste de matériel
- 3.Peser le soluté
- 4.Réaliser la solution
1. Calculer la masse de soluté à peser
On veut préparer une solution de volume mL et de concentration massique g/L
On rappelle la formule donnée dans l'introduction : Cm = m / V ou m = Cm x V
A l'aide du SuperCalculator 😁, trouver la masse de soluté à dissoudre (la masse doit apparaître dans la case violette).
SuperCalculator 😁
x
=
🔼 glisser / déposser 🔼
On veut préparer une solution de volume mL et de concentration massique g/L
Cliquer sur le matériel dont vous avez besoin (recliquer pour enlever la sélection):
✔️: sélectionné ❌: non sélectionné
✔️: sélectionné ❌: non sélectionné

éprouvette 25 mL
❌

éprouvette 100 mL
❌

fiole jaugée 50 mL
❌

fiole jaugée 100 mL
❌

fiole jaugée 500 mL
❌

fiole jaugée 1000 mL
❌

balance électronique
❌

pipette compte gouttes
❌

sulfate de cuivre anhydre
(anhydre : sans eau)
(anhydre : sans eau)
❌

pipette jaugée 10 mL
❌

verre de montre
❌

entonnoir
❌

pipeteur
❌

pissette d'eau
❌
On veut préparer une solution de volume mL et de concentration massique g/L
Dans cette partie, nous allons simuler la pesée du soluté que l'on à calculé à l'étape 1.
Il faut donc que la balance affiche une masse de g.
On veut préparer une solution de volume mL et de concentration massique g/L
Dans cette simulation, vous allez réaliser la solution