Physique Chimie 2de
Partie1 : Constitution de la matière
I. Corps purs et mélanges
II. Les solutions aqueuses
III. Dénombrer des entités
IV. Le noyau de l'atome
V. Le cortège électronique
VI. Les transformations physiques
VII. Les transformations chimiques
VIII. Les réactions nucléaires
Partie 2 : Mouvements et interactions
IX. Décrire un mouvement
X. Modéliser des actions mécaniques : les forces
XI. Le principe d'inertie
Partie3 : ondes et signaux
XII. Émission et perception d'un son
XIII. Les spectres d'émmissions et d'absorptions
XIV. Optique géométrique
XV. Signaux et capteurs
Chapitre 1 : Corps purs et mélanges
1. Espèces chimiques et mélanges
Une entité chimique est donc une brique élémentaire de matière.
Une espèce chimique est un ensemble d'entités chimiques identiques.

S'il est composé d'un seul type d'atome (Cuivre:Cu, dioxygène:O2) c'est un corps pur simple.
S'il est composé de plusieurs types d'atomes (eau:H2O) c'est un corps pur composé.
Si un corps est composé de plusieurs espèces chimiques, on parle de mélange

- 78% de diazote (N2)
- 21% de dioxygène (O2)
- 1% de gaz rare (dioxyde de carbone, eau, argon...)

- le sel de cuisine est un corps composé(d’ions Na⁺ et Cl⁻).
- Sur la photo le sel est composé d'un grand nombre d'ions
- Par contre un ion Na⁺ ou un ion Cl⁻ représente une entité chimique.
disposés de façon régulière dans un réseau cristalin.
➡️il est mélangé à l'eau (plusieurs espèces chimiques en solution).
➡️Les ions Na+ et Cl- sont désordonnés.
➡️Par contre, chaque ion (Na+ et Cl-) est une espèce chimique distincte.

- Les 2 liquides sont miscibles car le mélange est constitué d'une seule phase,
c'est un mélange homogène
- Les 2 liquides ne sont pas miscibles car le mélange est constitué de plusieurs phases (2),
c'est un mélange hétérogène
Des liquides sont non miscibles si ils constituent plusieurs phases lorsqu'on les mélange, on obtient un mélange hétérogène
2. Identification d'espèce chimique
a. La masse volumique et la densité
Activité : identifier un liquide grâce à sa masse volumiqueD' où la formule de la masse volumique: ρ = m / V
L'unité de ρ dépend de celles de m et V:
- Si m est en kilogramme(kg) et V en litre(L) alors ρ est en kg/L
- Si m est en gramme(g) et V en millilitre(mL) alors ρ est en g/mL
- Si m est en kilogramme(kg) et V en mètre cube(m3) alors ρ est en kg/m3, etc.
Les masses volumiques doivent avoir la même unité et la densité s'exprime sans unité
Par exemple:
- ρeau = 1g/mL = 1kg/L ( à retenir )
- ρéthanol = 0,789g/mL
- d = ρéthanol / ρeau = 0,789 / 1 = 0,789
b. Température de changement d'état
c. Tests d'identifications
Pour identifier une espèce chimique, on peut réaliser des tests chimiques, par exemple:
Chapitre 2 : Les solutions aqueuses
1.Un peu de vocabulaire

On mélange du sel (formule NaCl) et de l'eau.
de manière à obtenir une solution homogène.
On a réalisé une solution par dissolution d'un soluté dans un solvant:
- le soluté : le sel
- le solvant : l'eau
- la solution : eau salée
Exemples:
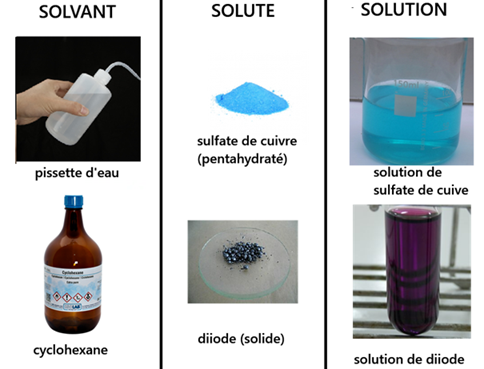
- Une solution aqueuse de sulfate de cuivre :
- à pour soluté : sulfate de cuivre
- et pour solvant : eau
- Si on mélange du diiode dans du cyclohexane on obtient une solution de diiode.
2. La concentration massique
- Cm = m / V ou m = Cm x V
- Cm la concentration massique en g/L.
- V est le volume de solution (et pas de solvant!) en litre (L).
- m est la masse de soluté en gramme (g).
Faire une application pour vérifier la compréhension intuitive de la concentration
3. La solubilité
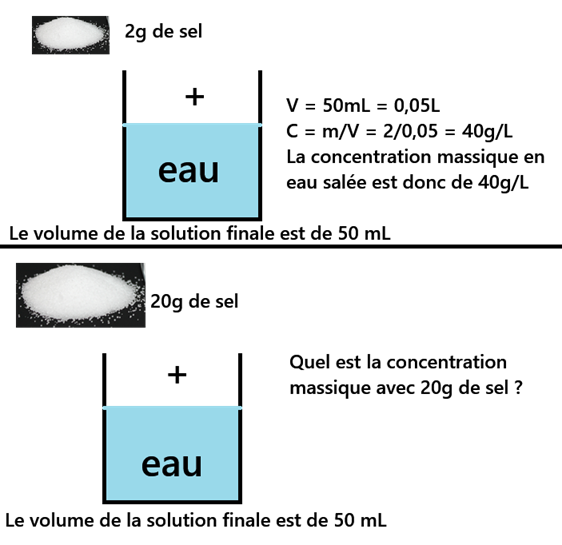
Mais dans la réalité, c'est faux parce qu'il va rester du sel solide au fond du bécher,
impossible à dissoudre.
On ne peut dissoudre qu'une quantité limitée de soluté dans un volume de solvant (saturation).
Cette limite est appelée solubilité, par exemple pour le sel dans l'eau à 25°C la solubilité est de 358 g/L.
Elle dépend de la nature du soluté et du solvant ainsi que de la température.
4. La dissolution
Activité1: comment réaliser une dissolution5. La dilution
a. Vocabulaire et notations
La solution diluée (donc moins concentrée) est appelée solution fille.
-
Notations:
- indice 0 pour la solution mère et l'indice f pour la solution fille
- Vf : volume de solution fille , V0 : volume de solution mère
- Cf : concentration molaire de la solution fille, C0 : concentration molaire de la solution mère
b. Formule des dilutions:
Activité2: 2.Formule des dilutions- C0 x V0= Cf x Vf
-
Remarques importantes:
- V0 et Vf doivent avoir la même unité (pas forcément des litres (L), on peut exprimer les 2 volumes en millilitre(mL) par exemple)
- De la même façon les 2 concentrations C0 et Cf doivent avoir la même unité.
- C0 et Cf peuvent être aussi des concentrations massiques.
Chapitre 3 : Dénombrer des entités
1.Différencier les atomes et les ions

Les atomes peuvent gagner ou perdre un ou plusieurs électrons pour gagner en stabilité.
Ils se transforment en ions qui possèdent une charge électrique,
comme l'ion cuivre Cu2+ qui possèdent 2 charges positives.
-
Donc:
- Si un atome perd un ou plusieurs électrons, il se transforme en ion positif appelé cation
- Si un atome gagne un ou plusieurs électrons, il se transforme en ion négatif appelé anion
- L'atome de cuivre (Cu) peut perdre 2 électrons → on obtient Cu2+ cation
- L'atome de chlore (Cl) peut gagner 1 électron → on obtient Cl- anion
- Exemples:
Au niveau macroscopique la matière est électriquement neutre.
Cu2+ et SO42- forme un composé ionique:
le sulfate de cuivre (CuSO4)
- L'ion négative se nomme anion exemple F- (l'ion F- possède 1 électron de plus que l'atome F (Fluor))
- L'ion positif se nomme cation exemple Fe2+ (l'ion Fe2+ possède 2 électrons de moins que l'atome Fe (Fer))
Au niveau macroscopique la matière est électriquement neutre,
les ions de charges opposées s'associent pour former des composés ioniques.
-
Par exemple:
- NaCl (sel de cuisine, structure cristalline ordonnée) se dissocie dans l'eau en Na+ et Cl-
- Al2(SO4)3(sulfate d'aluminium) se dissocie dans l'eau en 2 Al3+ et 3SO42-
2.Compter des entités la mole

Sélectionner la bonne valeur
- 100000
- 1011
- 1022
- 1031
- 1041
- 1057
permet de calculer N à partir de la masse m d'une entité:
- 1 entité → m1
- N entité → mch
- N = mch / m1
N étant très élevé (des milliards de milliards!), il est plus simple de changer d'unité.
En chimie, on compte en moles (symbole : mol) avec une grandeur noté n nommé quantité de matière.
Soit 1 mole = 6,022x1023 entités
NA = 6,022x1023 mol-1 est le nombre d'Avogadro
Chapitre 4: Décrire un mouvement
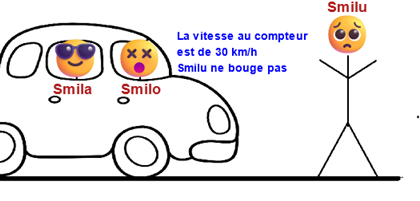
1. Besoin d'un référentiel
-
➡️Par rapport à la route (référentiel : la route), Smilu est immobile.
➡️Par rapport à la voiture (référentiel : la voiture), Smilu est en mouvement (la distance entre Smilu et la voiture diminue).
De la même façon, même si vous êtes immobile dans le référentiel terrestre,
vous êtes en mouvement par rapport...:
- ... au centre de la Terre qui tourne : référentiel géocentrique
- ... au centre du Soleil : référentiel héliocentrique
Pour simplifier, on peut le remplacer par un point situé au centre de gravité de l'objet.
C'est le modèle du point matériel.
Quelles simplification lorsqu'on utilise le modèle du point matériel pour la Terre ?
On associe au référentiel un repère d'espace et un repère de temps.
- référentiel géocentrique : référentiel lié au centre de la Terre
- référentiel héliocentrique : référentiel lié au centre du Soleil
- référentiel terrestre : référentiel lié à la surface de la Terre
2. Trajectoire
Activité1 : Le mouvement > 1. Description Activité2 : Le mouvement > 2. La courseLa trajectoire d'un point matériel, dans un référentiel d'étude donné,
correspond à la courbe formée par l'ensemble des positions successivement occupées par le point matériel lors de son mouvement.
Savoir caractériser un mouvement : voir activité1 ci-dessus
3. Le vecteur vitesse
Activité3 : Le mouvement > 3. Vitesse moyenne Activité4 : Le mouvement > 4. Vitesse instantannée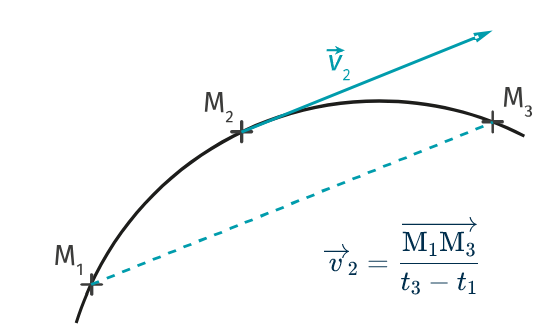
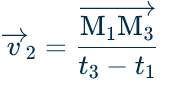
- le sens : de M1 vers M3, donc le sens du mouvement
- la direction : →v2 et →M1M3 sont colinéaires.
Il est, en tout point, tangent à la trajectoire, et orienté le sens du mouvement.
Application : Influence du référentiel sur la vitesse pour un mouvement rectiligne
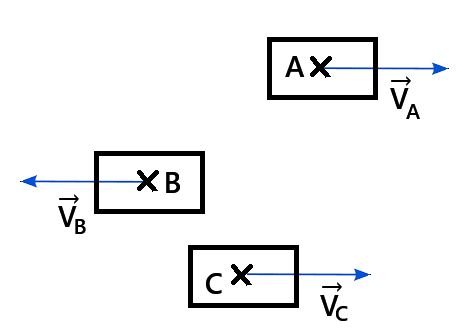
- VA/B : Vitesse de A par rapport à B (système : A, référentiel : B)
- VC/B : Vitesse de C par rapport à B (système : C, référentiel : B) , ect .....
- A et B se déplacent en sens contraire : VA/B = VA + VB = 80 + 30 = 110 km/h
- A et C se déplacent dans le même sens : VA/C = |VA - VC| = 80 - 60 = 20 km/h
Chapitre 5: Modéliser des actions mécaniques : les forces
1. Les forces (exemple du poids)
a. Forces......... et Forces...........

-
On peut identifier 2 types de forces:
- à gauche : les frorces à distance
- à droite : les frorces de contact
-
Une force résulte de l'interaction entre 2 objets:
- L'acteur, celui qui crée la force
- Le receveur (le système), celui qui subit la force
- Le vecteur (ou flèche) poids est noté →P.
- Une force possède 4 caractéristiques:
- Point d'application → où est exercé la force
- La direction → c'est la "droite d'action" : verticale, horizontale, 30° par rapport à l'horizontale ...
- Le sens → c'est l'orientation de la direction : vers le haut, vers le bas, vers la droite....
- La valeur → elle est exprimée en Newton (N)
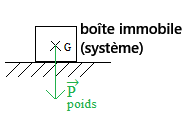
- Pour le poids →P d'un système les caractéristiques sont:
- Point d'application → centre de gravité du système
- La direction → verticale
- Le sens → vers le bas
- La valeur → elle est donnée par la formule du poids P = mg.
- P : poids du système en Newton (N)
- m : masse de l'objet en kilogramme (kg)
- g : accélération de l'apesanteur g = 9.81 N/kg
Exemple : Calculer et représenter le poids d'une voiture de masse 600 kg.
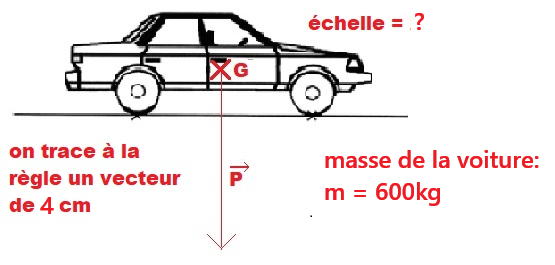
- P = mg = 600 x 10 = 6000 N
- 6000 N → 4 cm
- échelle? → 1 cm
- donc l'échelle = (6000 x 1)/4 = 1500 N/cm
2. Principe des actions réciproques
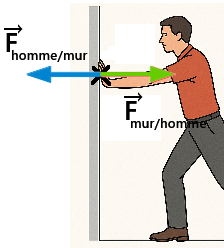
3. D'autres exemples de forces
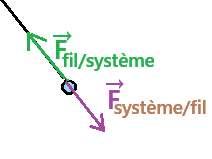
a. Force exercée par un fil (pendule simple)
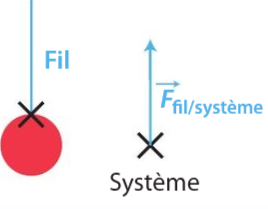
- point d'application : point de contact entre le système et le fil
- direction : verticale
- sens : vers le haut
- valeur : poids du système P = mg
b. La force exercée par un support
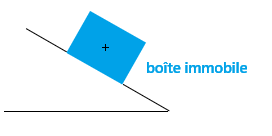
la force →R compense exactement le poids de ce corps : →R = →P
c. La force d'interaction gravitationnelle

- de la distance entre les 2 centres de gravités des masse (noté d)
- des masses mA et mB des deux corps
- Si la distance entre les masses augmentent → la force diminue
- Si les masses augmentent → la force augmente
-
Les hypothèses ci-dessus sont confirmées par la théorie puisque
la force de gravitationnelle est proportionnelle à (mAmB)/d²
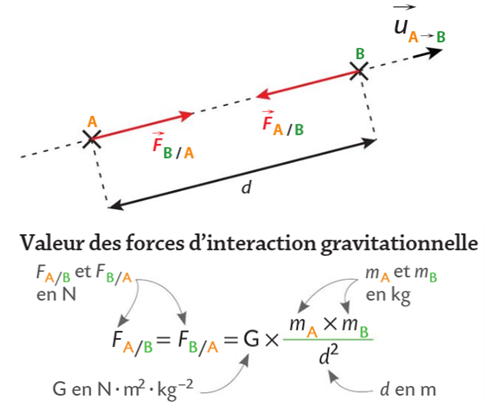
➡️une direction : la droite par le centre des corps A et B
➡️un sens : de B vers A
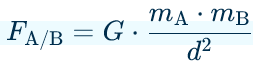 exprimée en Newton(N)
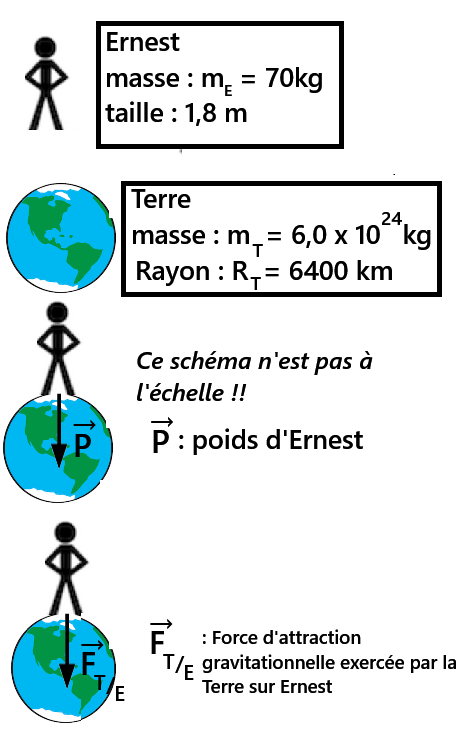
exprimée en Newton(N)d. Relation entre le poids et la force gravitationnelle

Oui absolument, c'est une des grandes idées de Newton avec les trois lois du mouvement
qu'il expose dans son traité :
"Philosophiæ Naturalis Principia Mathematica".
Le poids est un cas particulier de la force gravitationnelle.
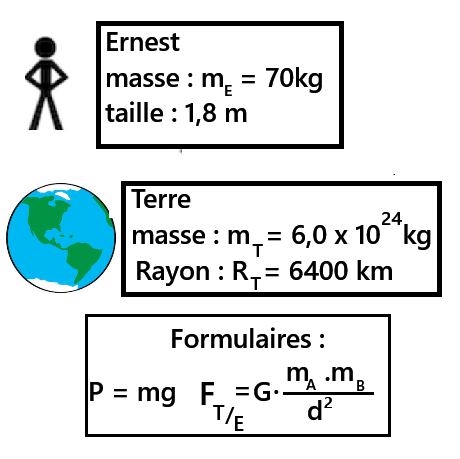
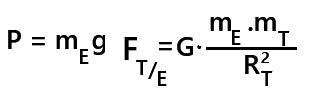
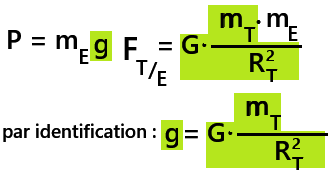
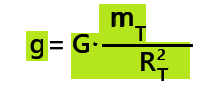
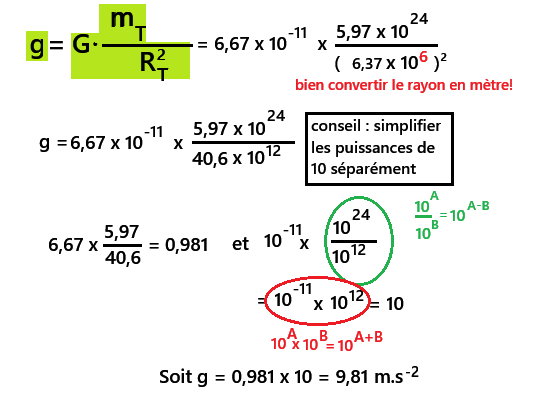
➡️mT = 5,97 x 1024 kg
➡️RT = 6,37 x 103 km
➡️G = 6,67 x 10-11 N.m2.kg-2
Chapitre 6: Le principe d'inertie
1. Cadre de l'étude
-
➡️ le système : on utilisera le modèle du point matériel
➡️ le référentiel : on utilisera le référentiel Terrestre
2. Comment varie le vecteur vitesse?
- simulation1:
➡️ Si la vitesse à une direction et un sens constants:
➡️ le système ne peut pas "tourner" donc:
➡️ le mouvement est rectiligne.
- simulation2:
➡️ Si le vecteur vitesse (valeur, direction, sens) reste constant.
➡️ le mouvement est rectiligne uniforme.
- simulation3:
➡️ Pour modifier un mouvement, il faut une force résultante non nulle.
➡️ Si la résultante des forces est nulle le système persévère dans son mouvement rectiligne uniforme.
3. Principe d'inertie
Si les forces qui s'exercent sur un système se compensent,
ce système est soit immobile soit en mouvement rectiligne uniforme.
La réciproque est également vraie : si le système est soit immobile soit en mouvement rectiligne uniforme,
alors les forces qui s'exercent sur lui se compensent.
Chapitre 7: Le noyau de l'atome
1. La composition d'un atome
Activité1 : 4. les modèles de l'atome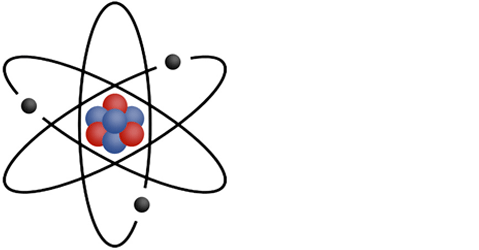
Cette représentation n'est pas correcte expérimentalement,
mais elle permet d'identifier facilement les particules qui composent un atome.
-
Le noyau (au centre) composé de 2 particules différentes:
- Les protons (en rouge)
- Les neutrons (en bleu)
- Les électrons (en noir) qui sont en mouvement autour du noyau
Un nucléon est une particule du noyau, donc un nucléon peut être un neutron ou un proton.
2. Symbole du noyau d'un atome
Activité2 : 1. Composition d'un atome- X : symbole de l'élément chimique
- A : Représente le nombre de nucléon
- Z : Représente le nombre de proton
du coup A = Z + N (car les nucléons représentent les neutrons et les protons)
3. Isotopes et éléments chimiques
Un élément chimique est défini par le nombre de protons (Z) dans son noyau.
Les isotopes sont les "variantes" d'un même élément chimique,
ils ont tous le même nombre de protons mais un nombre de neutrons (ou nucléons) différents.
Chapitre 5 : Le cortège électronique
1. La répartition par couche / sous-couche
a. Répartir les électrons sur les couches électroniques
Activité1 : 5.Répartition des électrons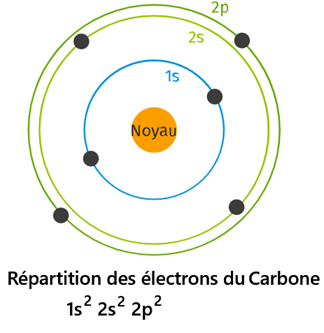
- Chaque couche est caractérisée par un nombre entier n>0 et comporte au maximum 2n² électrons.
- Chaque couche peut se diviser en sous-couche(s)
- Les sous-couches s, p, d peuvent contenir respectivement au maximum 2, 6 et 10 électrons
- les sous-couches se répartissent comme suit (règle de Klechkowski):
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s
b. La couche externe
2. Tableau périodique des éléments
Activité3 : 7.Tableau périodique des éléments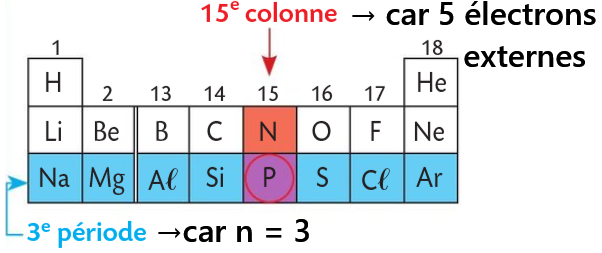
- La colonne dépend du nombre d'électrons externes:
1é,2é,3é,4é,5é,6é,7é,8é → c1,c2,c13,c14,c15,c16,c17,c18
Le Phosphore a 5 électrons de valence(3s2 3p3), il est donc sur la 15ème colonne. -
La rangée dépend du nombre de couches électroniques occupées:
Pour le Phosphore(P), on a 3 couches,
il se positionne donc sur la 3ème rangée.
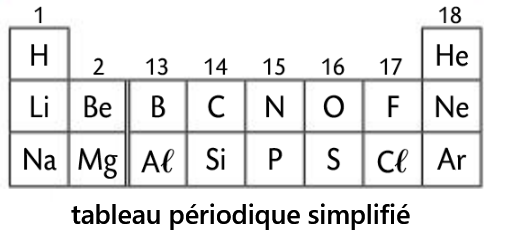
- Les gaz nobles sont situés sur la 18ème colonne
- Les gaz nobles sont très stables (pas de réaction)
- Cette stabilité est dûe aux électrons de valence.
- A part l'Hélium qui possède 2 électrons de valence, ils possèdent tous 8 électrons de valence.

Il a du vaincre une difficulté majeure : éviter que le filament brûle!
Il suffit donc de remplacer l'air avec un gaz comme l'Argon par exemple pour éviter une réaction de combustion.
Cette solution fut mise en oeuvre plus tard, Edison a préféré faire un vide partiel dans l'ampoule.
- les atomes de gaz nobles (He, Ne, Ar, Kr, etc.) présentent une grande inertie chimique.
- À l'exception de l'atome d'hélium qui possède deux électrons sur sa couche externe,
les autres atomes de gaz nobles ont tous huit électrons sur leur couche externe - La grande stabilité des gaz nobles est donc liée au nombre particulier d'électrons
qu'ils possèdent sur leur couche externe
3. Prévoir la formule d'un ion monoatomique
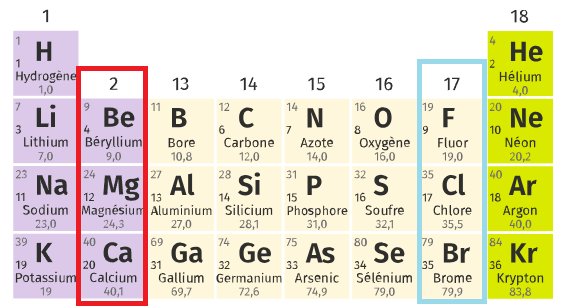
le plus proche de lui dans le tableau périodique.
-
Les atomes situés sur la 2ème colonne vont perdre 2 électrons:
- Be → Be2+, même configuration que He
- Mg → Mg2+, même configuration que Ne
- Ca → Ca2+, même configuration que Ar
-
Les atomes situés sur la 7ème colonne vont gagner 1 électron:
- F → F-, même configuration que Ne
- Cl → Cl-, même configuration que Ar
- Br → Br-, même configuration que Kr
-
On peut définir deux règles :
- la règle du duet (Z<=4): les atomes ont tendance à adopter la configuration de l'hélium (1s2)
- la règle de l'octet (Z>4) : les atomes ont tendance à obtenir 8 électrons de valence.
4. Formules de Lewis
a. Liaison covalente

D'après la règle de l'octet, l'atome de carbone doit acquérir
8 électrons de valence pour être stable,
Il en possède déjà 4, il va donc former 4 liaisons covalentes.
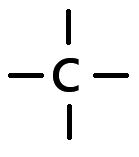
chaque atome contribue pour 1 électron de valence.
b. Doublet non liant
qui n’est pas engagée dans une liaison chimique avec un autre atome
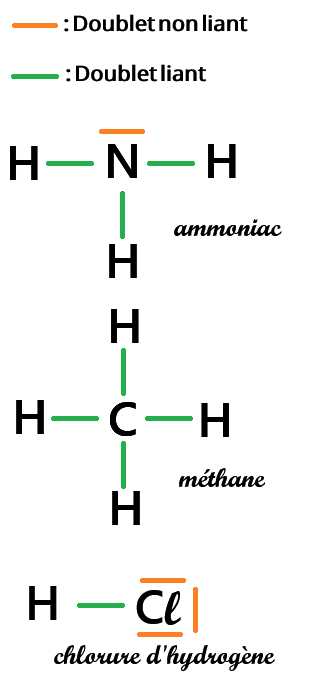
-
Pour le carbone (C):
- Z = 6 → 6 électrons → 1s2 2s2 2p2 → 4 électrons de valence
- Pour arriver à 8 électrons, le carbone doit former 4 liaisons covalentes
- Il reste 0 électron pour former des doublets non liants, donc le carbone n'en a pas
-
Pour l'azote (N):
- Z = 7 → 7 électrons → 1s2 2s2 2p3 → 5 électrons de valence
- Pour arriver à 8 électrons, l'azote doit former 3 liaisons covalentes
- Il reste (5 - 3 =) 2 électrons pour former des doublets non liants,
donc l'azote a (2/2 =) 1 doublet non liant.
-
Pour le chlore(Cl):
- Z = 17 → 17 électrons → 1s2 2s2 2p6 3s2 3p5 → 7 électrons de valence
- Pour arriver à 8 électrons, le chlore doit former 1 liaison covalente
- Il reste (7 - 1 =) 6 électrons pour former des doublets non liants,
donc le chlore a (6/2 =) 3 doublets non liants.
5. Energie de liaison
il faut une énergie de 436 kJ/mol pour 'casser' la liaison simple.
Chapitre 6 : Les transformations physiques
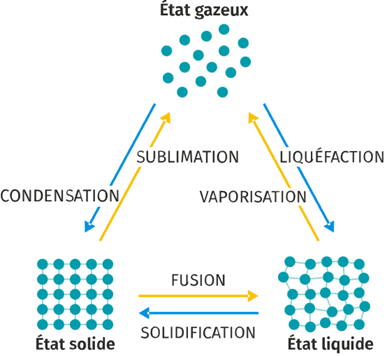
1. Changement d'état des corps purs
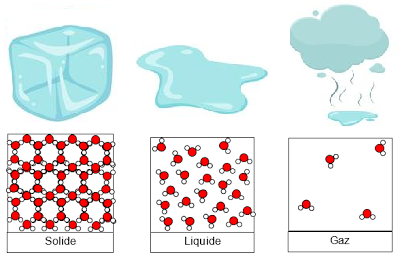
Associe correctement un état avec ses propriétés

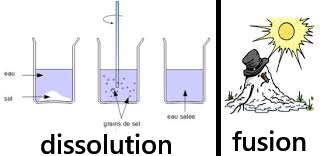
- Une fusion est un changement d'état physique, par exemple : le passage de la glace (eau solide) en eau liquide.
- Lors d'une dissolution, les particules d'un solide sont séparées de leur voisin par un solvant.
2. Les échanges d'énergie
a. Un peu de vocabulaire
C'est une perte d'énergie pour le système
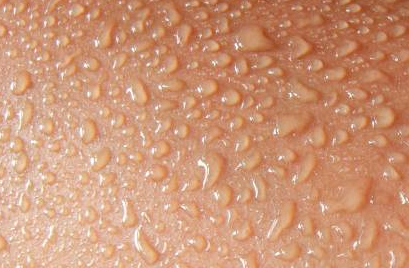
L'eau commence à s'évaporer, et pour cela, elle a besoin d'énergie.
Elle puise cette énergie sous forme de chaleur à la surface de ta peau,
ce qui fait baisser ta température corporelle locale, d'où la sensation de froid.
Du point de vue de la goutte d’eau, c’est un processus endothermique (gagne de l'énergie).
Du point de vue de la peau, c’est un processus exothermique (perd de l'énergie).

- en jaune ➡️ endothermique le système gagne de l'énergie:
- la fusion, la vaporisation ou la sublimation
- en bleu ➡️ exothermique le système perd de l'énergie
- la solidification, la condensation ou la liquéfaction
b. Equation de changement d'état
- solide (s)
- liquide (l)
- gaz (g)
c. Energie transférée
-
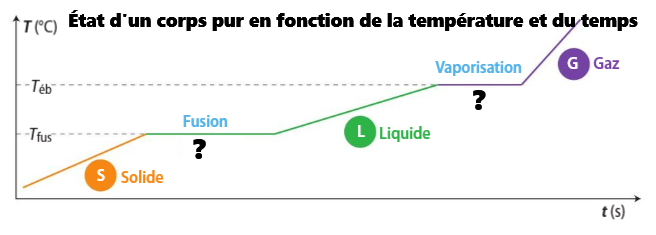
➡️Chaque transformation prend du temps.
➡️La température reste constante jusqu'à ce que la totalité du système change d'état.
-
➡️ Pour Teb, le système est à la fois gazeux et liquide.
➡️ Pour Tfus, le système est à la fois liquide et solide.
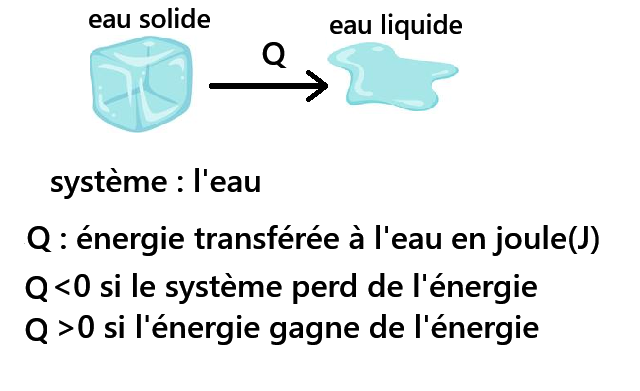
Cette quantité d'énergie est proportionnelle à la masse du corps pur qui subit la transformation.
On en déduit : Q=m⋅L avec:
- Q quantité d'énergie transférée en Joule (J)
- m masse du corps en kilogramme (kg)
-
L énergie massique de changement d'état (en J·kg-1.
L est aussi appelée chaleur latente de changement d'état.
Chapitre 7 : Les transformations chimiques
1. Révision : Dénombrer des atomes et des charges
Activité1: Les réactions chimiques > 1.Compter!2. La transformation chimique et son équation
Dans cette partie on utilisera la réactions entre les ions cuivre Cu2+ et sodium Na+ comme fil conducteur.a. Réactifs et produits
Un produit est une substance formée à la fin d'une réaction chimique.

on mélange une solution de sulfate de cuivre avec une solution d'hydroxyde de sodium.
données:
Ions cuivre:Cu2+, ion sulfate:SO42-, ion sodium:Na+, ion hydroxyde:OH-

On obtient un précipité bleu de sulfate de cuivre de formule Cu(OH)2
- Le produit est la substance formée : Cu(OH)2
- Les réactifs sont les ions Cu2+ et OH- (ils permettent de former le produit).
- H2O, SO42- et Na+ ne participe pas à la réaction ce sont des substances spectatrices
mais qui ne participe pas à la réaction.
3. Modéliser une transformation chimique par son équation de réaction
a.Ecrire une équation de réaction
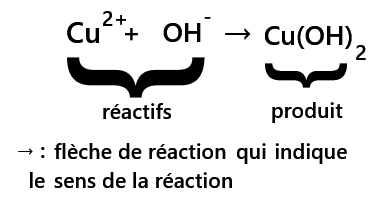
- Pour les réactif : 1Cu, 1H, 1O et une charge + (2+ et - donne 1+)
- Pour le produit : 1Cu, 2O, 2H et pas de charge
la matière et la charge électrique doivent se conserver. Pour que la matière se conserve il faut apporter la correction suivante :
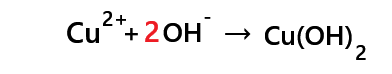
- Pour les réactif : 1Cu, 2O, 2H et pas de charge (2+ et 2- donne 0)
- Pour le produit : 1Cu, 2O, 2H et pas de charge
cela signifie qu'il est égal à 1

- liquide(l)
- solide(s)
- gaz(g)
- aqueux(aq)
c'est à dire dissous dans l'eau
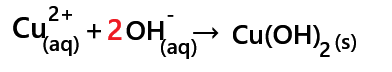
Elle doit respecter le principe de la conservation de la matière et de la charge électrique.
b. Bilan de matière et réactif limitant
- On mélange:
- 2 moles d'ions Cu2+, notation: n(Cu2+) = 2 moles
- 3 moles d'ions OH-, notation: n(OH-) = 3 moles
les ions OH- disparaissent deux fois plus vite que les ions Cu2+,
une méthode consiste à diviser la quantité de matière initiale de chaque réactif par son coefficient stoechiométrique.
La plus petite valeur correspond au réactif limitant.
- n(Cu2+)/1 = 2/1 = 2
- n(OH-)/2 = 3/2 = 1,5
Si tous les réactifs sont consommés , ils ont été introduits dans des proportions stoechiométriques.
4. Synthèse d'une espèce chimique (voir TP)
Chapitre 8: Les réactions nucléaires
1. Rappels
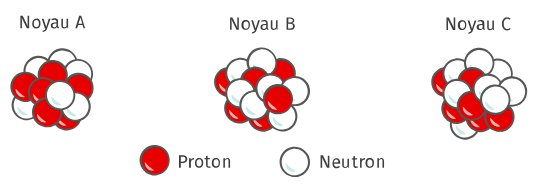
- Les 3 noyaux ont le même nombre de protons
- Il s'agit donc du même élément chimique, pour Z=6 c'est l'élément Carbone
- Les 3 noyaux ont un nombre de nucléons différents, ce sont donc par définition
3 isotopes du Carbone: 126C 136C 146C .
2. Equation d'une réaction nucléaire (exemple de la radioactivité)

c'est la radioactivité.
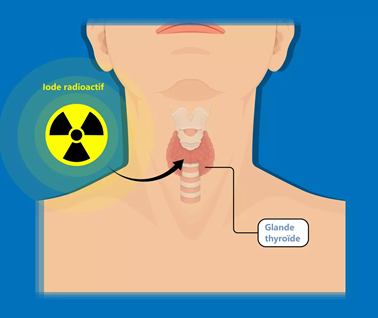
Il est à la fois utilisé comme marqueur et pour éliminer les cellules cancéreuses.
L'iode 131 se désintègre selon l'équation:
C'est la charge électrique qui se conserve.
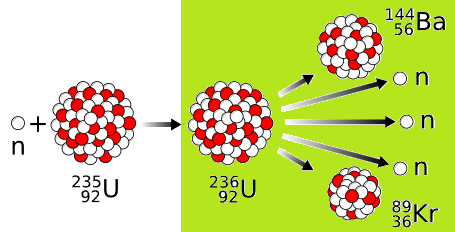
3. La fission nucléaire
un noyau dit lourd est séparé en deux noyaux plus légers et quelques neutrons.
Les étapes d'une réaction de fission :
Étape 2: Fission du moyau
Le noyau d'Uranium 236 est instable, il vibre, se déforme
puis se scinde en 2 noyaux plus petits, +2 à 3 neutrons.
Cette réaction est accompagnée d'une libération d'énergie.
C'est l'énergie utilisée dans les centrale nucléaire.
- Valeurs de A:
- réactifs : 236 nucléons
- produits : 144 + 89 + 3x1 = 236 nucléons
- Valeurs de Z:
- réactifs : 92
- produits : 56 + 36 + 3x0 = 92
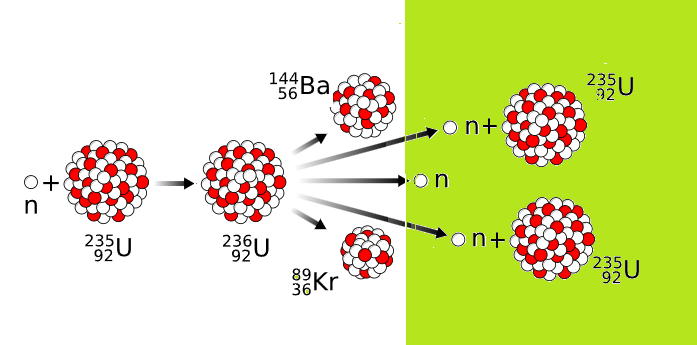
Étape 3: Réaction en chaîne
Les neutrons libérés peuvent déclencher des réaction en chaînes.
- réaction contrôlée : centrale nucléaire
- réaction non contrôlée : bombe atomique
4. La fusion nucléaire
se combinent pour former un noyau plus lourd, en libérant beaucoup d'énergie.
La réaction de fussion au coeur du soleil :
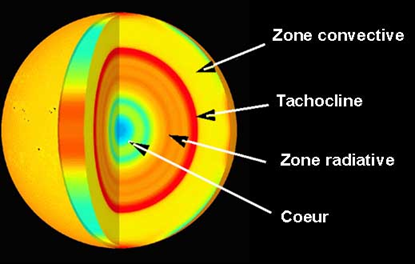
dans une zone appelée le noyau (ou cœur), qui représente environ 10 % du rayon solaire.
atteignables uniquement au centre du soleil:
- une température énorme : environ 15 millions de degrés Celsius
- une pression colossale : environ 200 milliards de fois la pression atmosphérique terrestre
- une densité élevé 150 fois la densité de l'eau
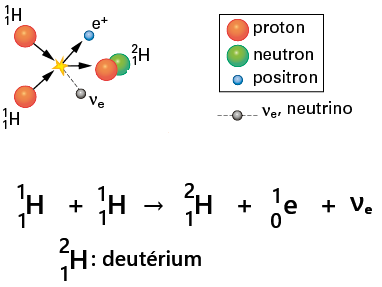
Étape 1 : Formation du deutérium
Le soleil est principalement composé d'hydrogène.
Deux protons fusionnent pour former du deutérium.
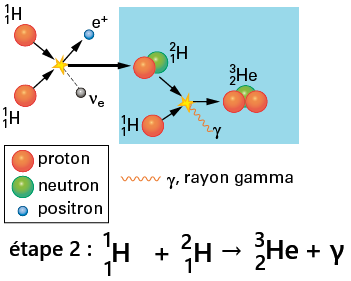
Étape 2 : Formation de l'hélium-3
Le deutérium formé à l’étape 1 fusionne avec un autre proton.➡️ Cela produit un noyau d’hélium-3.
➡️ Un rayonnement gamma (γ) est émis.
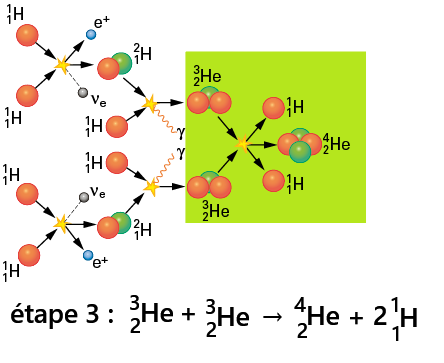
Étape 3 : Formation de l'hélium-4
Deux noyaux d'hélium-3 fusionnent.➡️ 2 protons sont éjectés.
➡️ Cela donne un noyau d'hélium-4 stable.
➡️ Cette réaction libère une grande quantité d'énergie, responsable du rayonnement solaire.
➡️ Il faudrait une température de 100 millions °C pour que les noyaux d'hélium-4 fusionnent.
➡️ Pendant environ 5 milliards d'années, les noyaux d'hélium vont s'accumuler au coeur du Soleil:
- le noyau se contractera
- la température augmentera,
- le Soleil gonflera : il deviendra une géante rouge
- Il commencera à fusionner de l'hélium ( 42He) en carbone ( 126C)
Partie3 : ondes et signaux
Chapitre 12 : Émission et perception d'un son
1. Propagation d'une onde sonore
a. Besoin d'un milieu matériel

- ➡️document2 : le son à besoin d'un milieu marériel (comme l'air) pour se propager.
- ➡️Si la lumière du soleil nous parvient, c'est qu'elle est capable de traverser le vide.
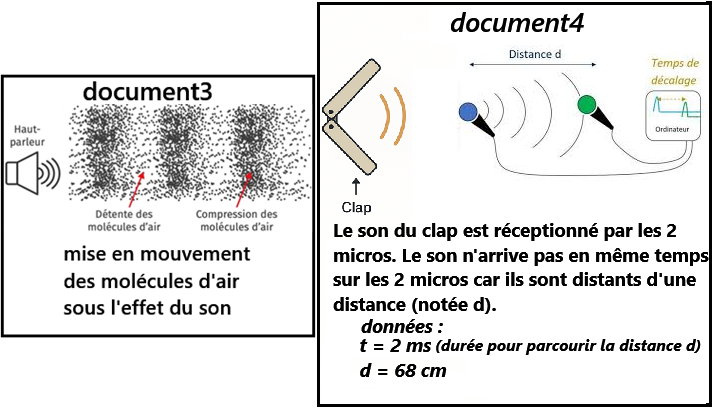
- ➡️document3 : le son crée une perturbation dans l'air qui se propage à vitesse constante.
- ➡️Si le son à une vitesse constante, on peut utiliser
la formule de la vitesse moyenne: Vs = d/t - On veut une vitesse en m/s donc t = 2ms = 0,002s et d = 68cm = 0,68 m
- Vs = d/t = 0,68/0,002 = 340 m/s
- document1 : la vitesse des ondes électromagnétiques est Ve = 300 000 km/s = 3x108 m/s
- Comparons les 2 vitesses : Ve / Vs = 3x108 / 340 ≈ 880000
- document4:
mais ça serait moins amusant...
dans un milieu matériel et sans transport effectif de matière.
L'onde sonore nécessite un milieu de propagation pour se déplacer :
ce milieu peut être l'air, le bois, le métal, l'eau ou tout autre matériau.
En l'absence de milieu matériel (c'est-à-dire le vide), il ne peut y avoir propagation du son.
Dans l'air le son se déplase à une vitesse de 340 m/s (à 20°C)
b. Propagation dans différents matériaux
Cette vitesse, appelée aussi célérité, dépend de la nature du milieu et de la température.
2. caractéristiques d'un son
C'est la caractéristique d'un signal périodique.
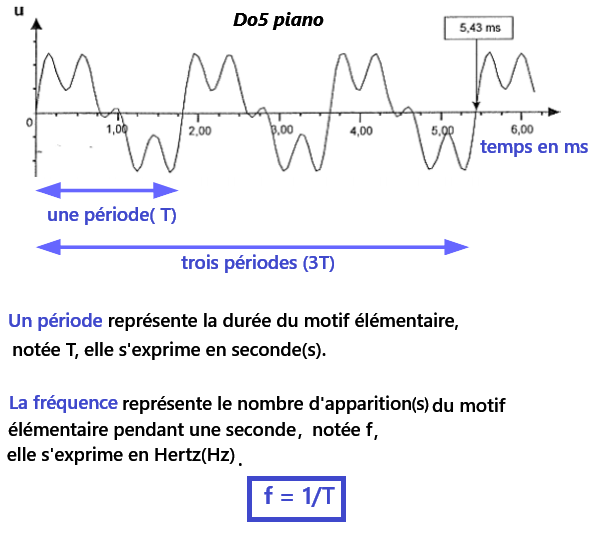
➡️Lorsque l'on réalise une mesure, il faut tenir compte d'un écart par rapport à la valeur exact.
➡️Cet écart correspond ici à une erreur de lecture.
➡️Si je mesure 3 périodes au lieu d'une seule, mon erreur sera divisée par trois,
donc mon résultat sera beaucoup plus précis.
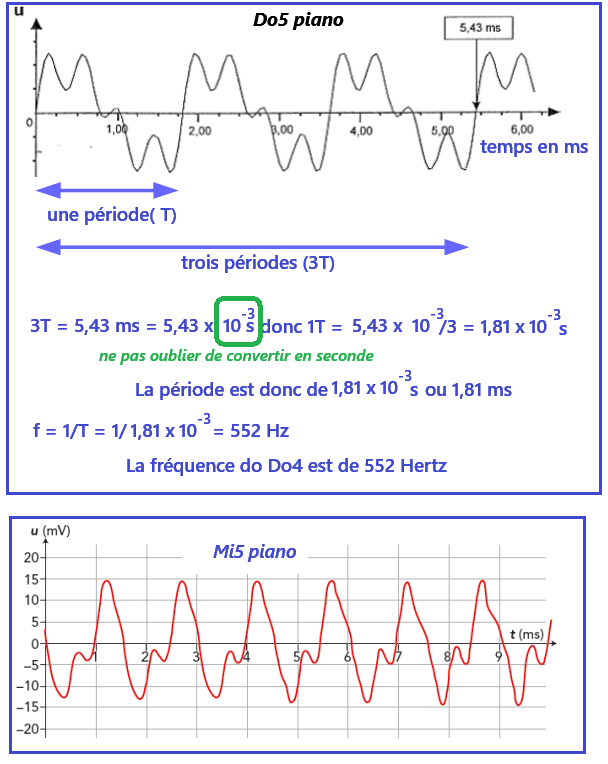
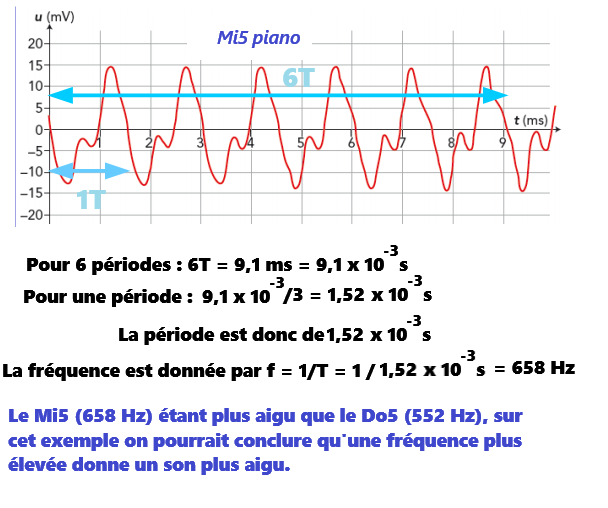
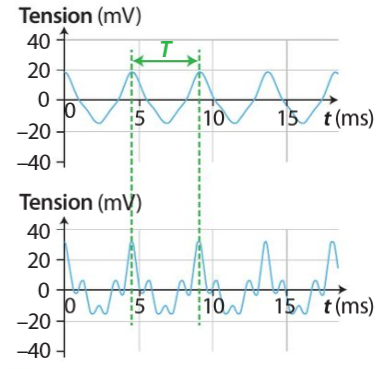
Une forme différente du signal implique néanmoins que l'on entend pas la même chose.
un signal est périodique lorsqu'il est composé d'un motif élémentaire qui se répète indéfiniment.
La période est la durée du motif élémentaire le plus petit, on la note T et s'exprime en seconde(s).
La fréquence notée f correspond au nombre de périodes du signal en 1 seconde:
- f = 1/T
- f : fréquance en Hertz (Hz)
- T : période en seconde (s)
La fréquence d'un son définit sa hauteur (fréquence augmente → son plus aigu...).
Deux sons différents de même hauteur, se distingue grâce à leur timbre.
Le domaine de fréquences des sons audibles est compris entre 20 Hz et 20 kHz,
au-delà de 20kHz, c'est le domaine des ultrasons.
Remarque: le domaine audible peut être différent pour les animaux
3. Intensité sonore et niveau d'intensité sonore

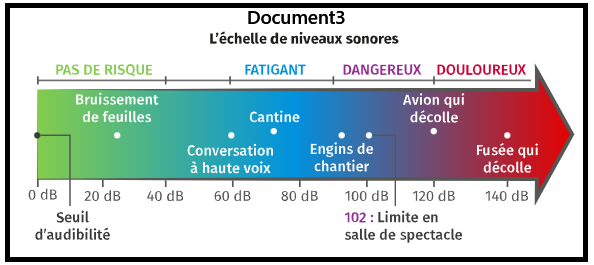
- ➡️Le gros avantage : les valeurs sont simples,
elles varient entre 0 et 140 dB. (document3) - ➡️L'inconvéniant : Les variations ne sont pas linéaires,
elles sont difficiles à appréhender. (document1)par exemple (document3):
- Bruissement des feuilles (21dB)
- Conversation à voix haute (60dB)
- Entre les deux (60-21=39dB), l'intensité du son a doublé 13 fois!
(39/3 = 13, document2)
- du niveau d'intensité sonore en décibel(dB)
- de la durée d'exposition
Chapitre 13 : Les spectres d'émissions et d'absorptions de la lumière
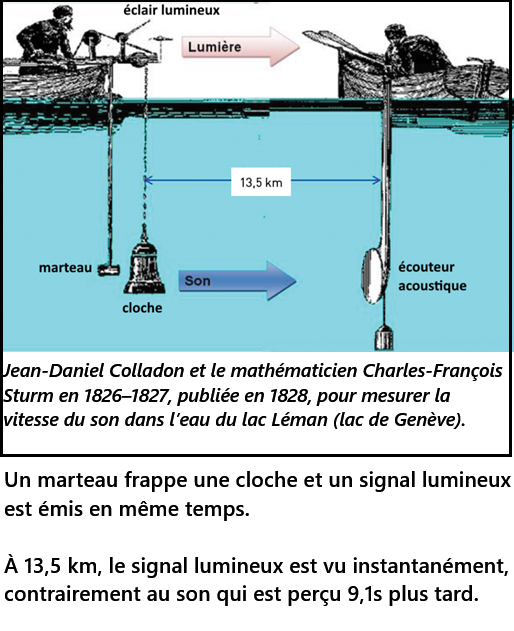
Activité1(historique et introduction) : Optique > 1.1. Vitesse des ondes électromagnétiques
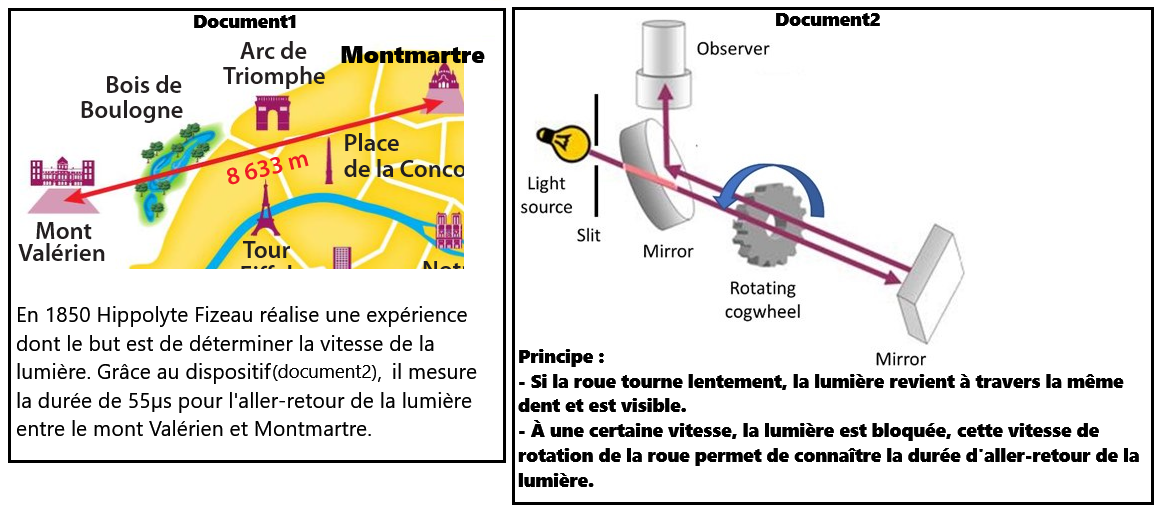
- la distance d parcourue par la lumière: 8633x2 = 17266m (x2 car aller-retour)
- La durée t : 55 µs = 55 x 10-6s = 5,5 x 10-5s (µ → micro → 10-6)
- On en déduit la vitesse : v = 17266/5,5 x 10-5 = 3,139 x 108 m/s = 313900 km/s
- À l'heure actuelle, les mesures donnent 299 792 km/s
se propagent toutes à la même vitesse dans le vide (ou dans l'air).
Cette vitesse, notée c, a pour valeur approchée:
2. Lumière blanche et lumières colorées
expérience (à montrer) : disque de Newton
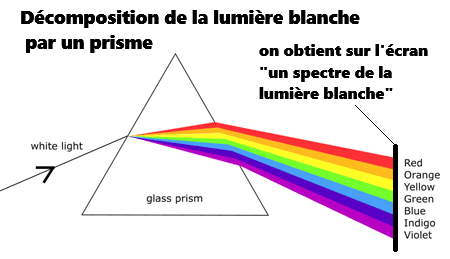
➡️Chaque longueur d'onde correspond à une lumière colorée ou radiation monochromatique.
➡️La lumière blanche est composée du mélange des radiations comprise entre 400nm et 800nm.
3. Les spectres d'émission et d'absorption

-
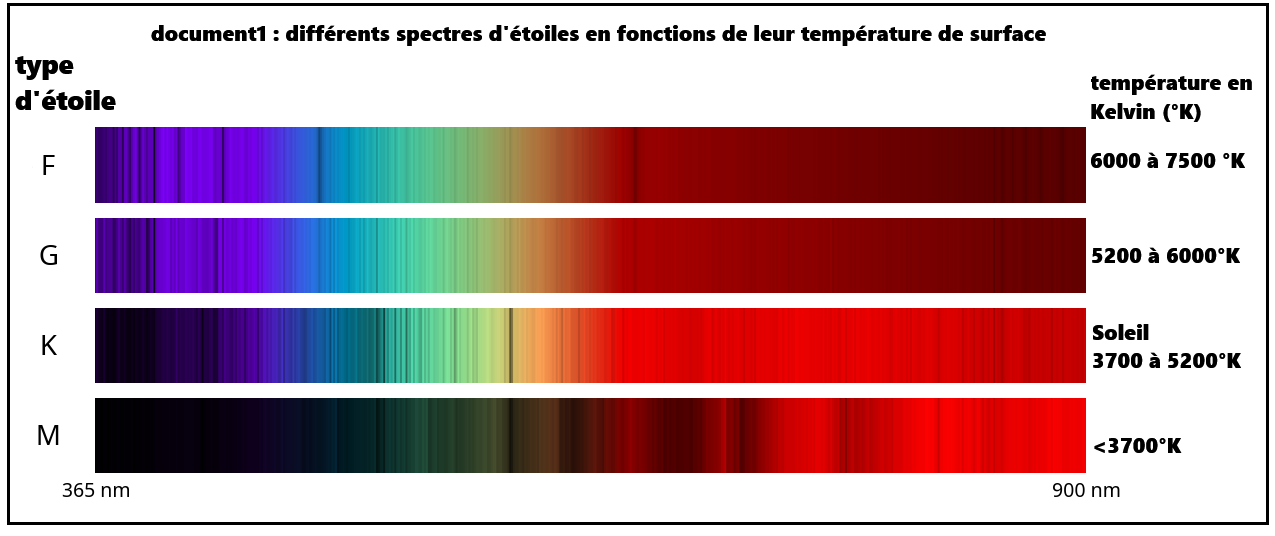
➡️Les 3 spectres correspondent à des spectres d'émissions.
- Un corps suffisamment chaud émet de la lumière visible.(doc1)
- De même pour le sodium(gaz) lorsqu'il est soumis au courant électrique.(doc2)
- ➡️On Remarque que plus la température est élevée, plus le spectre est riche en longueur d'onde faible.
- ➡️Un corps chaud émet une infinité de couleurs (spectre continue),
contrairement à l'élément chimique sodium qui n'émet que certaines couleurs(spectre de raies)
➡️Les longueurs d'ondes les plus faibles correspondes au bleu-violet.
➡️Il est donc logique que les étoiles les plus chaudes soient bleues.
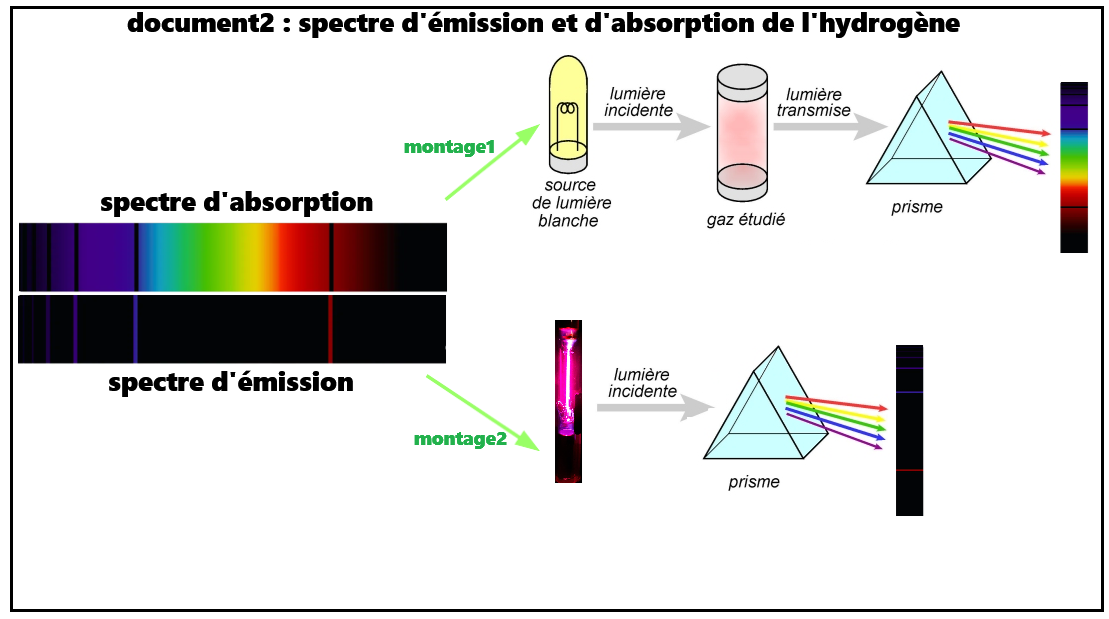
➡️L'ensemble des positions des raies est donc crarctéristique de l'élément hydrogène.
➡️On peut donc faire l'hypothèse (confirmée par l'expérience) que les raies sont dûes à l'atmosphère des étoiles.
Un spectre de la lumière est obtenue en la décomposant (avec un prisme par exemple) sur un écran.
Lorsque la température est suffisamment élevée, un corps peut émettre de la lumière visible.

Plus la température de surface d'un corps augmente,
plus elle est riche en radiations de courtes longueurs d'onde.

L'ensemble des raies est caractéristique de l'entité chimique.
L'entité chimique non excité peut absorber ces mêmes radiations.

De cette façon, on peut déterminer la composition des atmosphères des étoiles.
Chapitre 14 : Optique géométrique
Activité1 : II. Comment voit-on? Activité2 : III. Comment obtenir l'image d'un objet?1. Les lois de la réflexion et de la réfraction
Activité3 : III. Les lois de Snell-Descartesa. Loi de la réflexion
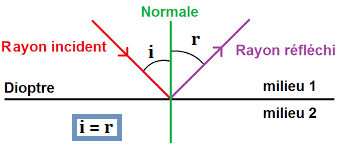
-
Le vocabulaire est important ici :
- Le dioptre : c'est la surface qui sépare deux milieux différents.
- La normale : c'est la perpendiculaire au dioptre,
les angles sont mesurés par rapport à la normale. - Le rayon incident : c'est le rayon qui "arrive" sur le dioptre.
- i : c'est l'angle d'incidence.
- r : c'est l'angle de réflexion.
D'après la loi de la réflexion : i = r
b. Loi de la réfraction
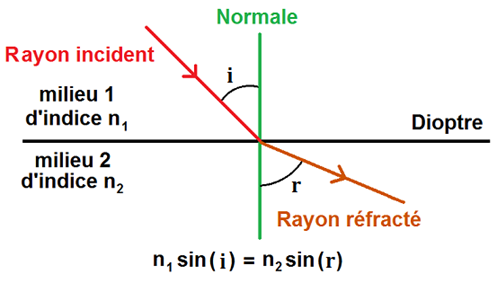
-
Loi de la réfraction : n1sin(i) = n2sin(r)
- i : angle incident
- r : angle réfracté
- n1 : indice de réfraction du milieu 1
- n2 : indice de réfraction du milieu 2
c. Application : dispertion de la lumière blanche par un prisme

l'indice de réfraction dépend de la longueur d'onde de la radiation qui le traverse.
Chaque radiation va être déviée avec un angle différent selon sa longueur d'onde.
- rouge → déviation minimale
- bleu-violet → déviation maximale
-
écart maximal entre l'indice de la radiation rouge et l'indice de la radiation violette:
- verre(crown BK7) : 0,016
- eau : 0,012
- air : 0,000021
La dispersion de la lumière du Soleil par les gouttelettes d'eau explique l'apparition des 🌈.
2. La lentille convergente
Pour illustrer cette partie : VI. Les lentillesa. 3 rayons pour tracer l'image d'un objet
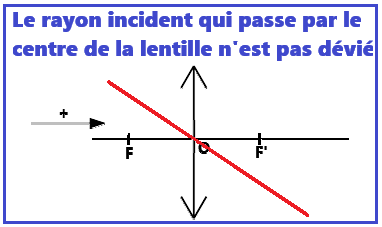
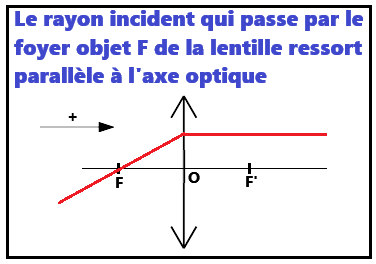
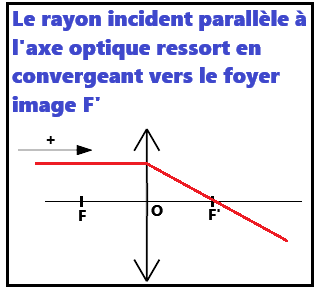
b. Construire l'image d'un objet par une lentille
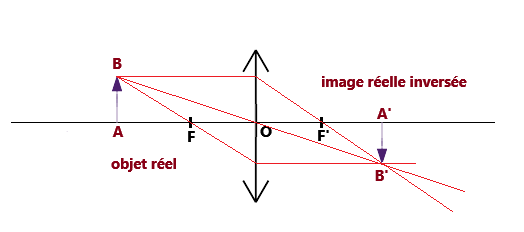
On trace les 3 rayons qui permettent de trouver l'image (B') de la source ponctuelle B.
On obtient une image réelle inversée.
c. Le grandissement Ɣ
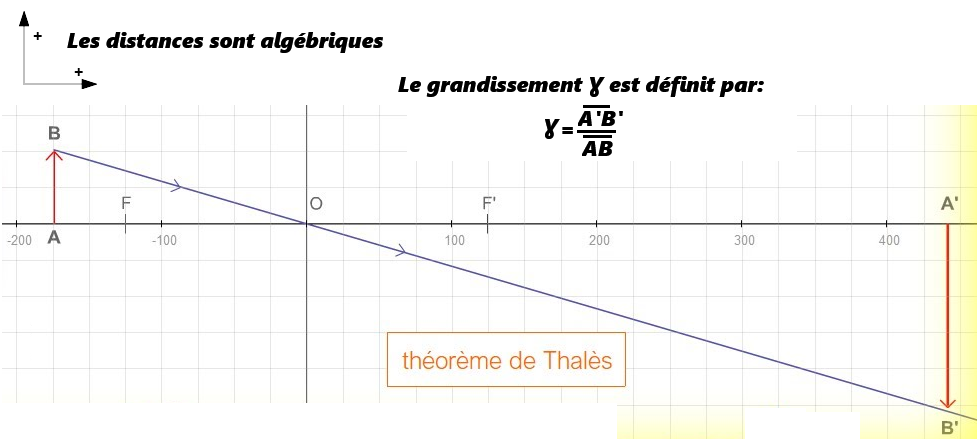
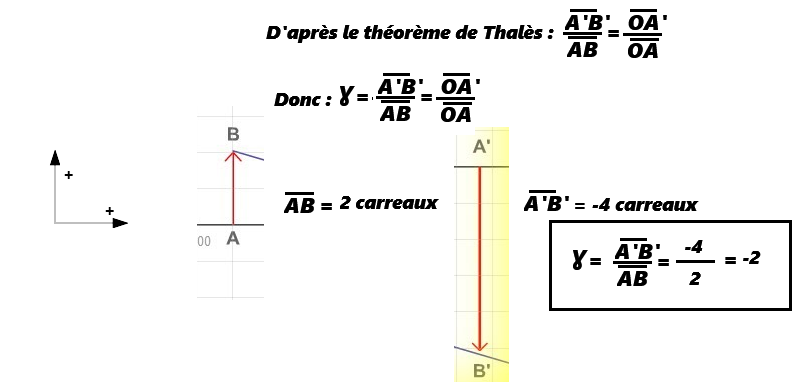
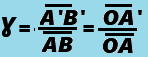
- Si |Ɣ| > 1, l'image est agrandie.
- Si Ɣ > 0, l'image est droite.
- Si Ɣ < 0, l'image est renversée.
- Ɣ n'a pas d'unité
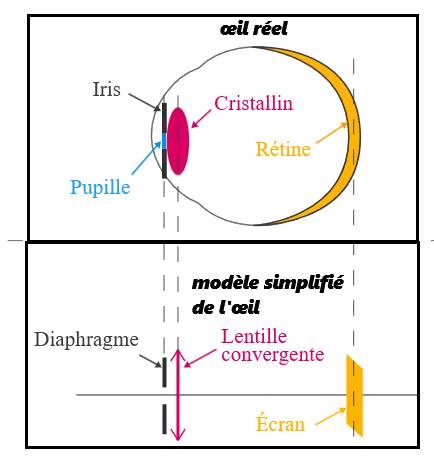
d. Modèle simplifié de l'œil
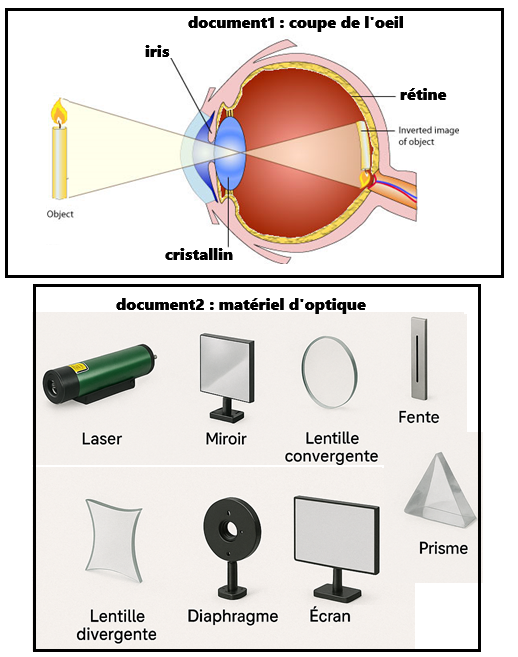
- l'iris ➡️ le diaphragme
limite la quantité de lumière - le cristallin ➡️ la lentille convergente
concentre la lumière sur la rétine -
la rétine ➡️ l'écran
réception de la lumière
Modèle simplifié de l'œil
Chapitre 15 : Signaux et capteurs
1. Généralités
Document ➡️ I.Grandeurs et symboles fondamentauxa. Un peu de vocabulaire
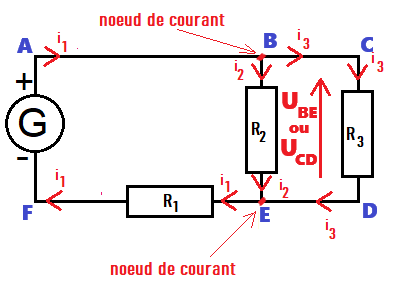
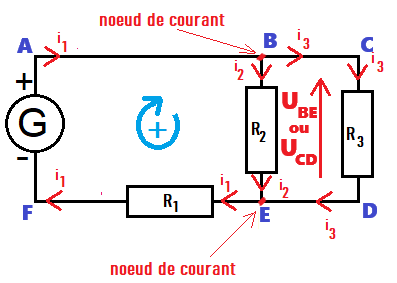
Un nœud est une connexion qui relie au moins trois dipôles entre eux.
Sur le circuit ci-contre, B et E sont des nœuds électriques.
Le circuit ci-contre possède trois mailles : ABEFA , BCDEB , ACDFA.
Il existe deux types d'association des dipôles entre eux, l'association en série et l'association en dérivation :
➡️deux dipôles sont en série s'ils sont situés dans la même maille et ne sont pas séparés par un nœud ;
(le générateur G et R1)
➡️deux dipôles sont en dérivation si leurs bornes sont connectées aux mêmes nœuds.
(les résistances R1 et R2)
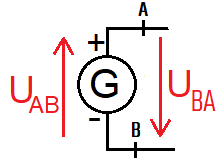
b. Grandeurs Tension et courant électrique
L'intensité du courant est notée I et s'exprime en ampère (A).
La tension U s'exprime en volt (V).
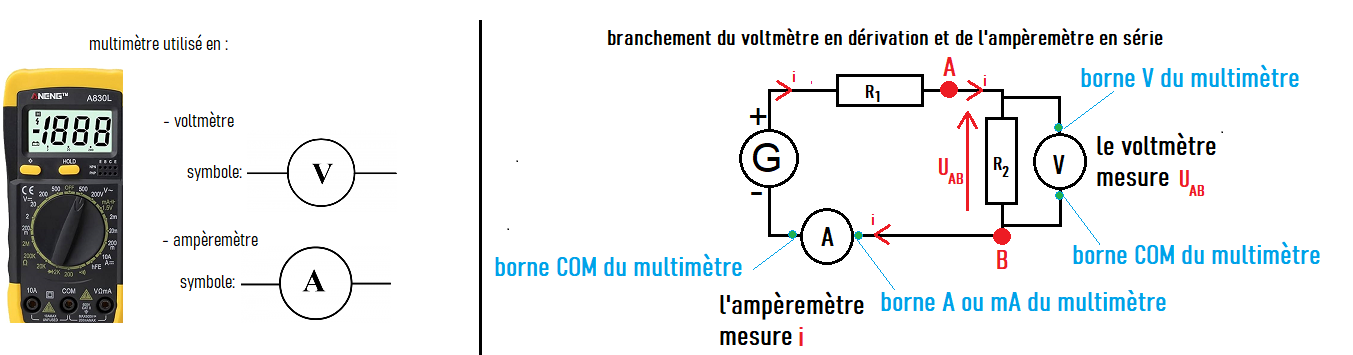
La tension électrique aux bornes d'un dipôle se mesure avec un voltmètre,
toujours placé en dérivation sur les bornes de ce dipôle.
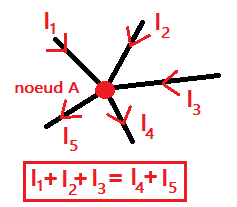
2. La loi des nœuds
Activité1 : VI. Loi des nœudsLa quantité d'électrons qui circulent dans le circuit se conserve.
La loi des nœuds traduit cette conservation : la somme des courants entrants à un nœud
est égal à la somme des courants sortants
3. La loi des mailles
Activité2 : VI. Loi des mailles
Loi des mailles :
la somme des tensions des dipôles le long d'une maille est égal à 0 V.
Vérifions que c'est bien compris!
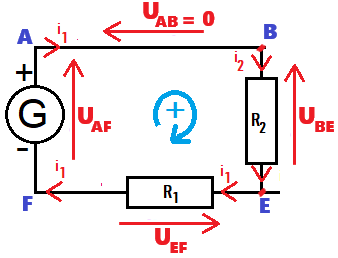
UAF - UAB - UBE - UEF = 0 (UAB = 0V)
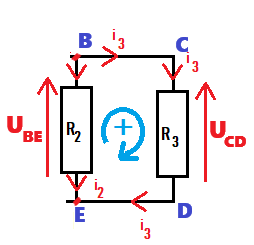
UBE - UCD = 0
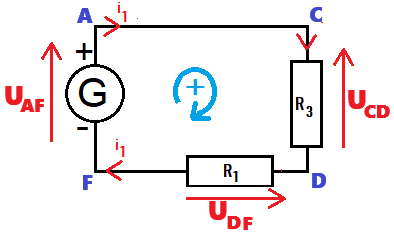
UAF - UAB - UCD - UDF = 0
4. Caractaristique d'un dipôle et loi d'Ohm
Activité3 : III.Loi d'Ohm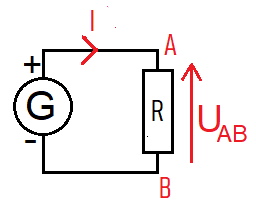
- UAB : tension aux bornes du résistor en Volt(V)
- R : résistance du résistor en Ohm (Ω)
- I : intensité du courant qui circule dans le résistor en Ampère (A)
Son expression est UAB = RI
Compléments : Activité4 : V.Caractéristique d'une pile document: IV.Conventions
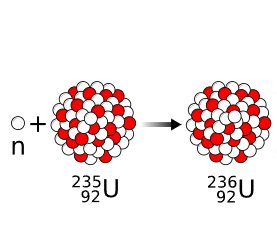
Étape 1 : Capture d'un neutron
Un noyau d'Uranium 235 capte un neutron.
Un noyau d'Uranium 236 instable est formé.
10n+ 23592U → 23692U