Les réactions d'oxydoréduction
A partir des observations du biologiste Galvani, le physicien italien Volta entreprend des recherches qui l'amènent à établir en 1793 sa "série des tensions pour les métaux".En 1800, il découvre la pile électrique qui porte son nom. Ces découvertes sont à l'origine de l'interprétation des phénomènes d'oxydoréduction.
I.Première notion d'oxydoréduction
1. Un métal peut-il réagir avec un ion métallique ?
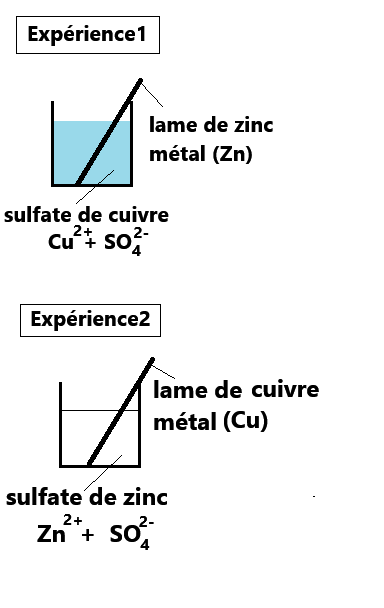
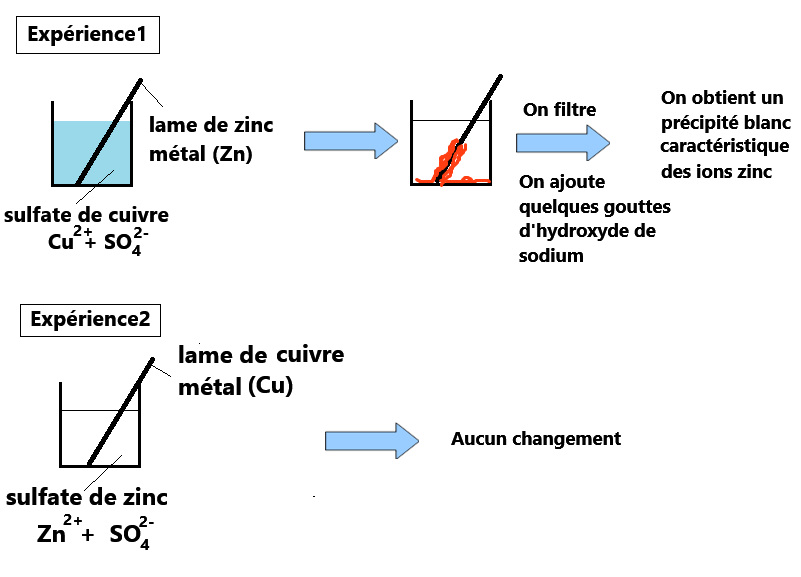
Observations pour l'expérience1:
Rappel : la couleur bleue est caractéristique de l'ion Cu2+ dans l'eau.
Maintenant c'est à vous d'interpréter l'expérience1 en sélectionnant les 10 bonnes réponses ci-dessous!
- La coloration bleue de la solution est beaucoup moins importante
- On observe un dépôt rouge-orange caractéristique du cuivre métal (Cu)
- On obtient un précipité blanc caractéristique des ions Zn2+
- Aucun changement donc il n'y a pas eu de transformation chimique
Rappel : la couleur bleue est caractéristique de l'ion Cu2+ dans l'eau.
Maintenant c'est à vous d'interpréter l'expérience1 en sélectionnant les 10 bonnes réponses ci-dessous!
réponses(s) justes : 0/10erreurs : 0
Bravo vous avez trouvé toutes les bonnes réponses!
2. Ecrire l'équation de la réaction
On procède par étapes:
Zn → Zn2+ + 2e- (oxydation : Zn perd 2électrons) Cu2+ + Zn + 2e-❌→ Cu + Zn2+ + 2e-❌ (équation bilan d'oxydoréduction)
Cu2+ + Zn → Cu + Zn2+ (équation bilan d'oxydoréduction)
Remarque les électrons se simplifient directement, si ce n'est pas le cas,
il faut multiplier au moins une des deux demi-équation par un coefficient pour simplifier les électrons.
- On écrit 2 demi-équations qui correspondent à la perte ou au gain d'un ou plusieurs électron(s)
- On fait la somme de ces 2 demi-équations pour obtenir l'équations bilan
Zn → Zn2+ + 2e- (oxydation : Zn perd 2électrons) Cu2+ + Zn + 2e-❌→ Cu + Zn2+ + 2e-❌ (équation bilan d'oxydoréduction)
Cu2+ + Zn → Cu + Zn2+ (équation bilan d'oxydoréduction)
Remarque les électrons se simplifient directement, si ce n'est pas le cas,
il faut multiplier au moins une des deux demi-équation par un coefficient pour simplifier les électrons.
- Dans l'expérience1 les électrons perdus par Zn sont captés par Cu2+
- Loxydant Cu2+ se transforme en Cu qui est un réducteur
- On a donc le couple Cu2+ / Cu
- De la même façon on a le couple Zn2+ / Zn
- Un couple s'écrit toujours sous la forme oxydant / réducteur
II. De manière générale
1. Les notions de bases
- Une espèce chimique capable de céder un ou plusieurs électron(s) est un réducteur
- Une espèce chimique capable de capter un ou plusieurs électron(s) est un oxydant
- Au cours d'une oxydoréduction l'oxydant d'un couple est réduit et le réducteur d'un autre couple est oxydé.
2. Une règle : Peut-on prévoir la réaction spontanée entre deux couples rédox ?
L'expérience2 montre qu'il ne suffit pas de réunir un oxydant et un réducteur pour avoir une réaction chimique.
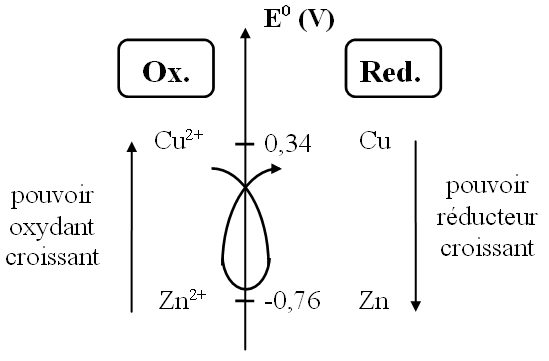

Les travaux de Volta ont permis d'associer un potentiel normal d’oxydoréduction E0 (en Volt(V)) à chaque couple oxydant/réducteur.
A l'aide de ces valeurs, un classement de tous les couples a donc été possible.
A l'aide de ces valeurs, un classement de tous les couples a donc été possible.
- Plus E0 est grand, plus l'oxydant du couple est fort et plus le réducteur est faible
- Cu2+ est donc plus oxydant que Zn2+
- Zn est plus réducteur que Cu
- La réaction d’oxydoréduction spontanée entre deux couples s’effectue toujours entre le réducteur le plus fort et l’oxydant le plus fort
(règle dite "du gamma"). - Ceci explique pourquoi Cu2+ et Zn réagissent alors que Zn2+ et Cu non
3. Exercice de synthèse
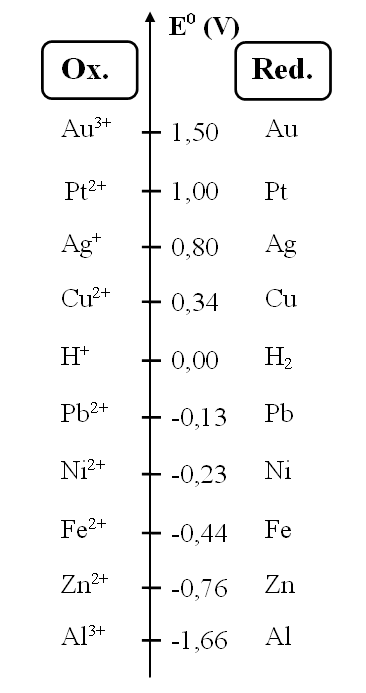
a. Sélectionner les 3 métaux qui s'oxyde le moins facilement
Bravo, vous avez trouvez!
Le potentiel le plus grand correspond au réducteur le plus faible donc celui qui réagit le moins.
b. Indiquez si une réaction est possible entre:
c. glisser-déposer pour obtenir l'équation de réaction entre Ag+ et Fe
Bravo, vous avez trouvé la bonne solution
🔽 glisser / déposser 🔽
( → + e-)x
( + e-→ )x
Fe + 2Ag+ → Fe2+ + 2Ag
III. Autres couples oxydant/réducteur important
Il existe d'autres réactions d'oxydoréduction où les métaux n'interviennent pas. On utilise souvent des solutions aqueuses acidifiées.

- H2O est présent dans le solvant
- Si on a ajouté de l'acide, H+ est présent aussi car il est responsable du caractère acide de la solution
- H2O et H+ sont donc susceptibles d'intervenir dans les équations de réaction

a. glisser-déposer pour obtenir la réaction possible entre les couples I2 / I- et S2O82- / SO4-
Bravo, vous avez trouvé la bonne solution
🔽 glisser / déposser 🔽
( + e- → )x
( → + e-)x
S2O82- + 2I- → 2SO4- + I2
b. glisser-déposer pour obtenir la réaction possible entre les couples MnO4- / Mn2+ et O2 / H2O2
Bravo, vous avez trouvé la bonne solution
🔽 glisser / déposser 🔽
(
+ e-
+
→
+
)x
(
→
+
+
e-)x
10e-❌ + 2MnO4- + 16H+❌6H+ + 5H2O2 → 2Mn2+ + 8H2O + 5O2 + 10H+❌ +10e-❌
2MnO4- + 6H+ + 5H2O2 → 2Mn2+ + 8H2O + 5O2