Relation entre masse et masse molaire
a. Compter par mole
Une goutte d'eau contient des milliards de milliards ... de molécules d'eau
Pour exprimer la quantité de matière en chimie, on utilise une grandeur qui contient beaucoup d'éléments:
- En chimie on compte les élément en mole (mol en abrégé)
- 1 mole contient 6,02x1023 entités
- La quantité de matière s'exprime donc en mole avec le symbole n
- Ce nombre 6,02x1023, est appelé nombre d'Avogadro noté NA
Exemples :
- n(H2O) = 1 mole correspond à 6,02x1023 molécules d'eau
- n(H2O) = 0,5 mole correspond à 0,5x6,02x1023 molécules d'eau soit 3,01x1023 molécules.
Si N est le nombre d'éléments comptés à l'unité : N = n x NA
Remarque: dans la pratique, on utilise souvent n sans avoir forcément besoin de N,
mais il est important de savoir que n représente un nombre de "paquets".
b. De la mole à la masse
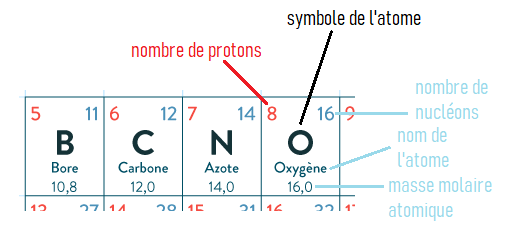
Si on considère un des éléments chimiques comme par exemple l'oxygène(O) et que l'on pèse 1 mole d'atomes d'oxygène,
on obtient ce que l'on appelle la masse molaire atomique de l'oxygène.
C'est une valeur de référence que l'on trouve dans le tableau périodique, dont voici un extrait ci-dessous:
Il est impossible de répertorier les masses molaires des molécules (qu'on appelle masse molaire moléculaire),
il y en a beaucoup trop.
- Une molécule est un "assemblage" d'atomes
-
La masse molaire moléculaire est donc égale à la somme
des masses molaires atomiques de tout les atomes qui composent la molécule.
Par exemple:
- On sait que MH = 1,0 g/mol et MO = 16,0 g/mol
- Donc M(H2O) = 2 x MH + 1xMO
- M(H2O) = 2x1 + 1x16 = 18 g/mol
Je vérifie que j'ai bien compris:
On peut en déduire que MC2H6O = 46,0 g/mol
c. De la masse molaire à la masse.

Pour ce sucre, je peux déterminer les grandeurs suivantes:
- n → quantité de matière en mol
- M → masse molaire en g/mol
- m → masse en g
Pour 1 mole → m = M (par définition M représente la masse d'une mole)
Pour n mole(s) → m = n x M ou n = m/M.
Récapitulons ce que l'on vient de voir avec l'exemple ci-dessous:
- Si on pèse un morceau de sucre, on trouve un peu près 6g
- La molécule qui compose le sucre est le saccharose de formule C12H22O11
La masse molaire du sucre est MC12H22O11 = 342g/mol et la quantité de matière d'un morceau de sucre (6g) est n = 0,25 mol.
Maintenant, c'est à vous de jouer! Une masse ou une quantité de matière (random) à trouver.
Sur quel composé préférez-vous travailler?:
Relation entre masse, masse molaire et quantité de matière




La masse molaire doit apparaître sur la case violette
de SuperCalculator 😁.