cliquez sur la bonne couleur
ion chargé négativement
atome (pas de charge)
ion chargé positivement
cartes retournées: 0/18
cliquez sur la bonne couleur
cartes retournées: 0/18
L'atome ⚛️

Votre mission est de trouver le nombre d'électrons externes de l'élément chimique ci-dessous:
- Pous vous aider:
- la règle de Klechkowski: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f
- vous pouvez utiliser le superCalculator😁 qui permet d'additionner les électrons des sous-couches saturées
Symbole du noyau:
126CL'élément possède électrons
La répartition électronique donne :
La couche externe est la
On a donc électron(s) externe(s).
Donc vous avez
1. What we do ??
- Configuration électronique
- Structure électronique
- Cortège électronique
- Formule électronique
Ici, on se contentera d'apprendre à répartir les électrons sur des couches / sous-couches électroniques.
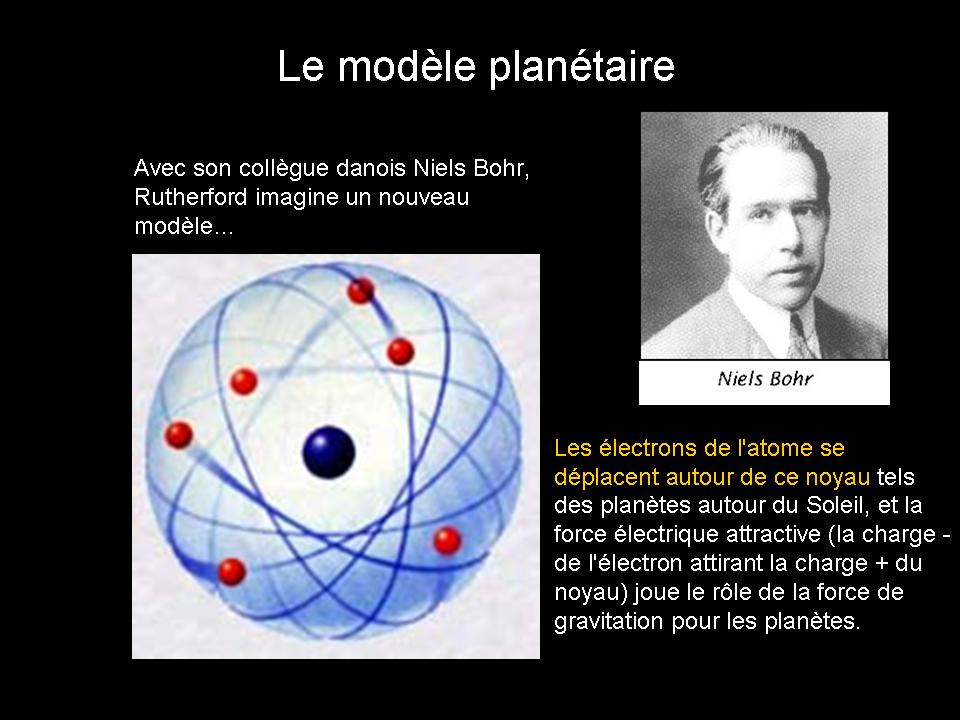
Et pour faire ça, on utilisera le modèle planétaire de Bhor (dépassé) et la règle de Klechkowski.
La représentation d'une trajectoire circulaire pour les électrons est bien sûr fausse mais elle permet de comprendre plus facilement comment répartir les électrons.
2. La répartition par couche / sous-couche
Les termes couches, sous-couches sont hérités du modèle de Bohr, qui faisait orbiter les électrons sur des trajectoires circulaires.On va avancer par étape : a) couches → b) sous-couches → c) j'ai plus de 18 électrons à répartir.
a. Répartir les électrons sur les couches électroniques
- Si on est logique on réparti un électron dans une couche puis dans une sous-couche
- Chaque couche est caractérisée par un nombre entier n>0 (ça commence à 1!)
- Une couche contient 2n² électrons au maximum (exemple: la 3ème (n=3) contient 2 x 3² = 18 électrons)
- n = 1 → 1ère couche , n = 2 → 2ème couche ect...
- Lorsqu'on a 18 électrons ou moins à répartir, il faut saturer les couches précédentes pour passer à la suivante.
- On note le numéro de la couche avec le nombre d'électron en exposant : 3² signifie "j'ai 2 électrons sur la couche numéro 3"
- la 1ère couche peut contenir 2n² = 2x1² = 2é → 12 (reste 12-2 =10é)
- la 2ème couche peut contenir 2n² = 2x2² = 8é → 12 28 (reste 10-8 =2é)
- la 3ème couche peut contenir 2n² = 2x3² = 18é → 12 28 32 , 32 car il ne me restait plus que 2 électrons à mettre sur ma 3ème couche.
b. Répartir les électrons sur les sous-couches
- chaque sous-couche est caractérisée par un nombre entier l tel que 0 ≤ l < n (ça commence à 0 et ça va jusqu'à n-1)
- Par exemple:
- n = 1 → l prend la valeur 0
- n = 2 → l peut prendre les valeurs 0 ou 1
- n = 3 → l peut prendre les valeurs 0, 1 ou 2...
- Chaque sous-couche correspond à une lettre qu'il faudra utiliser dans la répartition des électrons (les 3 premières sont à connaître):
- pour l = 0 on parle de la sous-couche s (pour sharp)
- pour l = 1 on parle de la sous-couche p (pour principal)
- pour l = 2 on parle de la sous-couche d (pour diffuse)
- pour l = 3 on parle de la sous-couche f (pour fine), ect...
- Chaque sous-couche peut contenir 2(2l+1) électrons, il faut saturer les sous-couches pour passer à la suivante.
- sous-couche s → l=0 → 2(2l+1) = 2, s contient au maximum 2é
- sous-couche p → l=1 → 2(2l+1) = 6, p contient au maximum 6é
- sous-couche d → l=2 → 2(2l+1) = 10, d contient au maximum 10é
- sous-couche f → l=3 → 2(2l+1) = 14, f contient au maximum 14é
- Maintenant qu'on a toutes les règles, on va les appliquer pour répartir 12 électrons, sachant qu'on à déjà la répartition sur les couches : 12 28 32
- 12→ les 2é vont sur la sous-couche s → 1s2
- 28→ 2é vont sur la sous-couche s → 2s2 , 6é sur la sous-couche p → 2p6 donc pour la 2ème couche on a 2s2 2p6
- 32→ les 2é vont sur la sous-couche s → 3s2
La répartition électronique de nos 12 électrons est : 1s2 2s2 2p6 3s2 .
- On remplit les 2 premières couches de la même façon: 1s2 2s2 2p6 , il reste 18 - 10 = 8 électrons à répartir sur la 3ème couche
- 38→ 2é vont sur la sous-couche s → 3s2, 6é sur la sous-couche p → 3p6 donc pour la 3ème couche on a 3s2 3p6
- Finalement on obtient : 1s2 2s2 2p6 3s2 3p6
c. Répartir plus de 18 électrons
A partir de 19 électrons la règle qui consiste à dire: il faut saturer les couches précédentes pour aller à la suivante ne fonctionne plus, on applique la règle de Klechkowski:
Vous voyez qu'après avoir remplit la 3p (3p6), on va sur la 4s et après avoir remplit cette couche (4s2) on repart sur la 3ème en remplissant 3d, ect...
d. La couche externe
1. Les particules
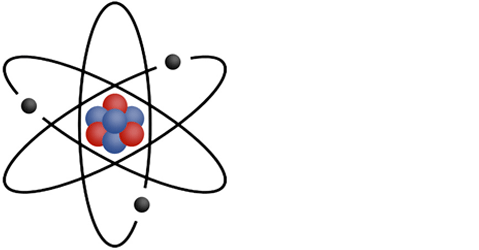
Cette représentation n'est pas correcte expérimentalement,
mais elle permet d'identifier facilement les particules qui composent un atome.
-
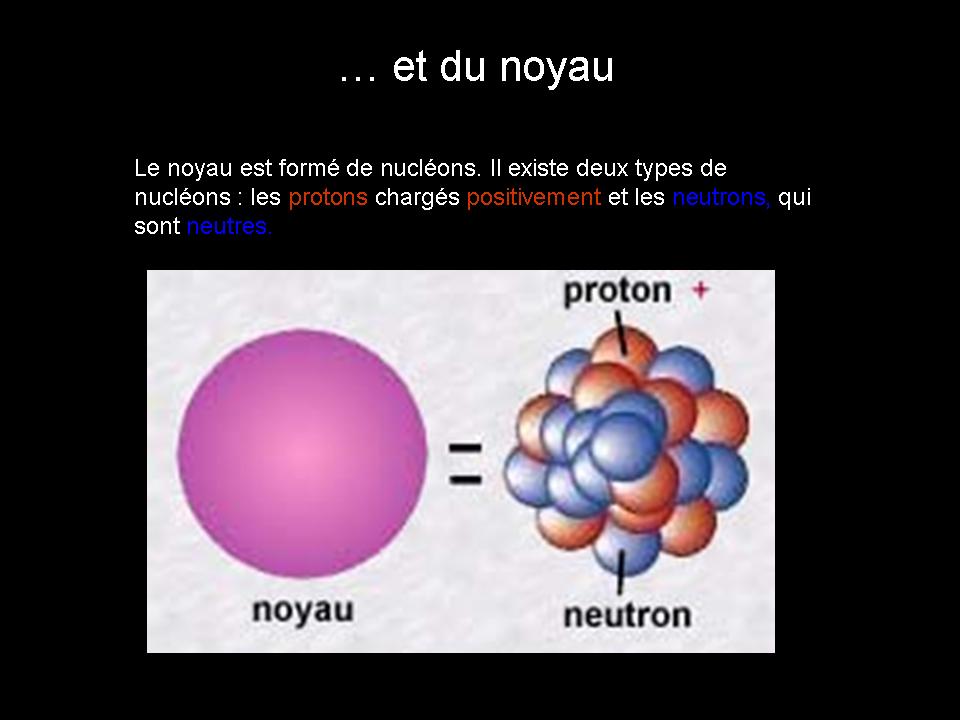
Le noyau (au centre) composé de 2 particules différentes:
- Les protons (en rouge)
- Les neutrons (en bleu)
- Les électrons (en noir) qui sont en mouvement autour du noyau
Un nucléon est une particule du noyau, donc un nucléon peut être un neutron ou un proton.
2. Les valeurs clées des particules
| Nom | Masse (kg) | charge électrique (C) |
|---|---|---|
| électron | mélectron = 9,109 x 10 -31 kg | -e = 1,602 x 10-19C |
| proton | mproton = 1,673 x 10 -27 kg | +e = 1,602 x 10-19C |
| neutron | mneutron = 1,675 x 10 -27 kg | 0 |
- L'unité de la charge électrique est le Coulomb (C)
- e est la charge élémentaire, vous avez remarqué que les protons et les électrons portent des chargent opposées!
3. Exploiter les valeurs clés : Réfléchissez et cliquez!
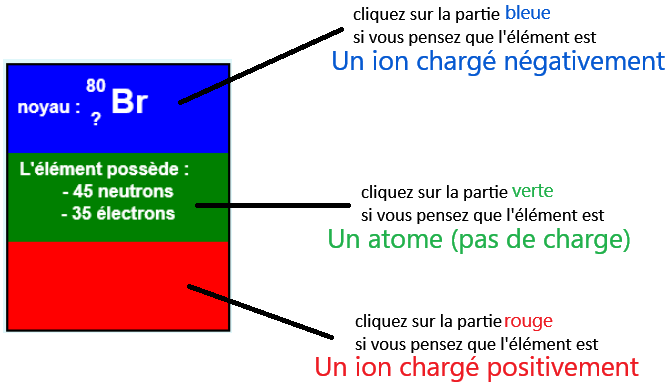
- Gagner un/plusieurs électron(s) → L'ion est chargé négativement (anion) , exemple: l'ion fluor F- (l'atome a gagné un électron)
- Perdre un/plusieurs électron(s) → L'ion est chargé positivement (cation) , exemple: l'ion cuivre(II) Cu2+ (l'atome a perdu 2 électrons)
- Sachant que le noyau est composé de neutron(s) (charge 0) et proton(s) (charge +e),
- Le noyau est forcément chargé positivement!
- Le piège ça serait un noyau sans proton (et donc sans charge) mais ça n'existe pas, le plus petit atome est l'Hydrogène et son noyau possède un proton.
Si on prend 3 chiffres significatifs au lieu de 4, on obtient la même valeur : 1,67 x 10 -27 kg pour les deux.
Du coup, on peut dire que les 2 masses sont pratiquement identiques et que la masse d'un nucléon est mnucléon = 1,67 x 10 -27 kg.
Attention tout de même à ne pas arrondir systématiquement les valeurs, il faut faire attention au contexte, surtout dans l'infiniment petit!
Si on y va "à la louche" pour calculer le rapport entre mnucléon et mélectron, on obtient : nucléon / mélectron ≈ 2000.
Ce qui signifie qu'on peut la plupart du temps, négliger la masse des électrons devant la masse des nucléons, c'est à dire négliger la masse des électrons par rapport à la masse du noyau.
La masse de l'atome est donc concentrée dans son noyau.
Ce que les chiffres du tableau ne montrent pas, c'est que le diamètre de l'atome est 100 000 fois! plus grand que le diamètre de son noyau.
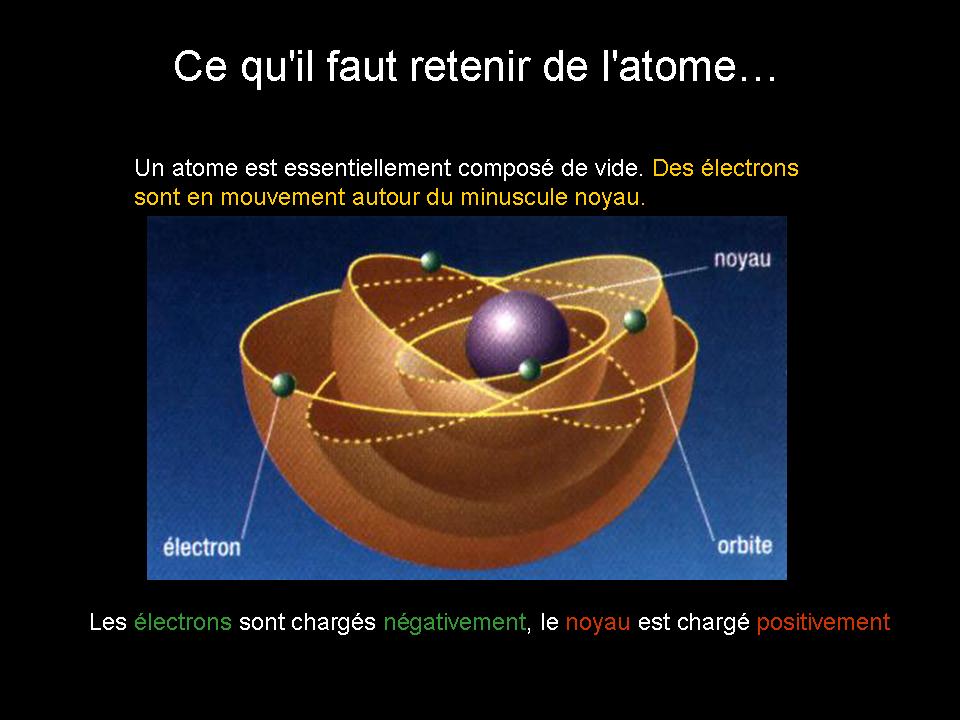
L'atome est principalement constitué de vide!
C'est Rutherford qui l'a montré avec la célèbre expérience "de la feuille d'or" en 1909.
Protons et électrons portent des charges électriques opposées, concernant les conséquences sur les atomes, prenons l'exemple de l'atome de Carbone.
Il possède 6 protons et donc 6 électrons, la charge globale de l'atome est +6e - 6e = 0. L'atome de carbone à une charge globale nulle comme tous les atomes:
Les atomes sont électriquement neutres.
On sait que lorsqu'un atome gagne ou perd un ou plusieurs électrons, il se transforme en ion. Un électron possède une charge négative donc :
4. Symbole du noyau
- X : symbole de l'élément chimique
- A : Représente le nombre de nucléon
- Z : Représente le nombre de proton
- Exemple de l'atome de carbone : 126C
- A = 12 , donc l'atome de carbone possède 12 nucléons
- Z = 6 , donc l'atome de carbone possède 6 protons
- Un atome possède aussi Z électrons, soit 6 électrons pour le Carbone
- N = A - Z = 12 - 6 = 6, le Carbone possède 6 neutrons
- La charge - est la charge globale de l'ion ( la charge du noyau est elle, toujours positive)
- 9 protons (Z=9)
- 19 nucléons (A=19)
- 10 neutrons (N = A -Z = 19 - 9 = 10)
- 10 électrons car l'atome F possède 9 électrons (Z = 9), l'ion F- possède un électron en plus donc 10
5. Isotopes et éléments chimiques
Vous avez déjà entendu parler du Carbone 14 ou de l'Uranium 235? Il servent à quoi ces chiffres?
Et bien ces chiffres permettent d'identifier l'atome, parce que le Carbone 12 ou l'Uranium 238 existe aussi!
Plus précisément, ces chiffres correspondent au nombre de nucléons. Donc Carbone 12 et Carbone 14 ont des noyaux différents, mais pourquoi portent-ils le même nom du coup?
- Voici 3 noyaux d'atomes de Carbones différents : 126C
136C
146C .
- Un nombre de nucléons différents(12, 13, 14) et donc un nombre de neutrons différents(6, 7, 8)
- Même symbole (C), même nom (Carbone) et ... même nombre de protons(6)!
Un élément chimique est définit par le nombre de protons (Z) dans son noyau.
Les isotopes sont les "variantes" d'un même élément chimique, ils ont tous le même nombres de protons mais un nombres de neutons (ou nucléons) différents.
- Le Carbone 12 possède N = A - Z = 12 - 6 = 6 neutrons
- Le Carbone 13 possède N = A - Z = 13 - 6 = 7 neutrons
- Le Carbone 13 possède un neutron de plus, il est donc un peu plus lourd
- Le nombre d'Avogadro serait plus faible (il faudrait moins d'atomes pour atteindre 12g).
C'est le nombre d'atomes de Carbone dans 12g de Carbone 12.
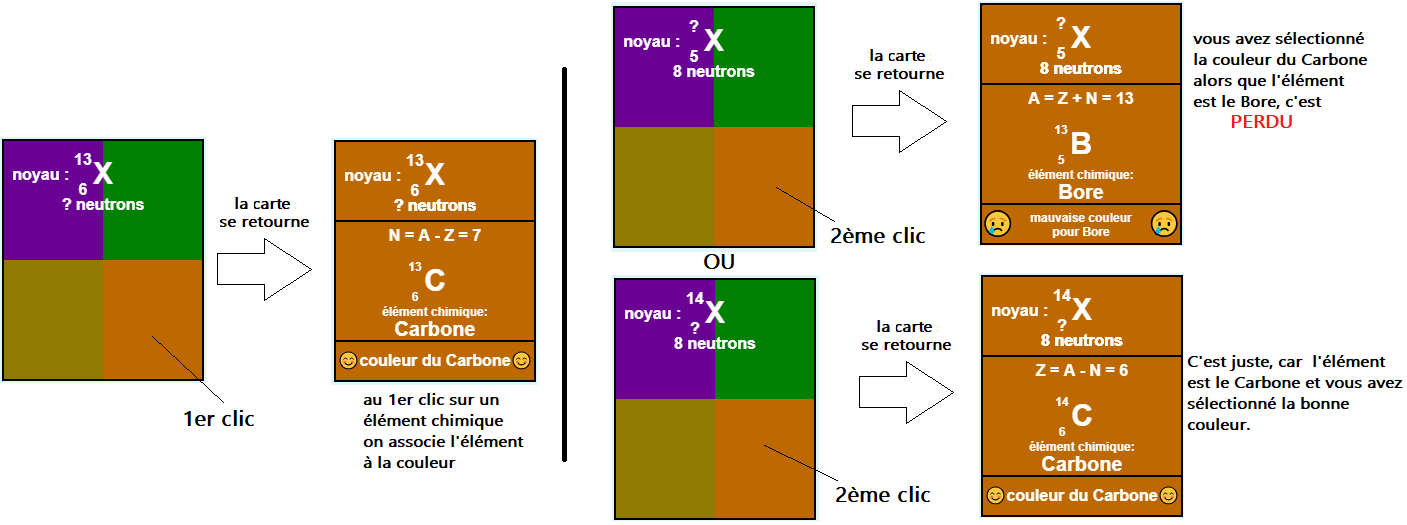
Les règles du jeu : elles sont très simples!
18 cartes sont disposés devant vous pour chaque carte, il faut cliquer sur la bonne couleur, c'est tout...
Un détail ... vous avez perdu si vous faites une erreur, donc pour terminer le jeu il faut retourner les 18 cartes sans vous tromper 😁.
Les règles du jeu : elles sont très simples!
18 cartes sont disposés devant vous pour chaque carte, il faut cliquer sur la bonne couleur, c'est tout...
- Un élément chimique (exemple le Carbone) est associé à la couleur que vous avez choisie au départ
- Une couleur est associée à un élément chimique.
- Le jeu est gagné lorsque vous avez retourné les 18 cartes sans vous tromper.
- C'est d'abord une représentation:
- Mais (on l'espère), personne n'a cette tête là! Un modèle scientifique doit être conforme à la réalité
- Ici, conforme ne veut pas dire égal, mais il doit s'en rapprocher le plus possible, pour cela, il faut respecter certains critères:
- Un modèle scientifique est validé par l'expérience (une seule expérience peu prouver qu'il est faux)
- Il est établi à partir d'hypothèses qui doivent être clairement énoncées.
-
Par exemple:
- La lumière se propage en ligne droite
-
Lorsque le milieu est opaque elle est renvoyée et/ou absorbée.
Lorsque la lumière change de milieu (exemple : elle passe de l'air à l'eau (phénomène de réfraction)), elle est déviée.
Dans un milieu homogène et transparent la lumière se propage en ligne droite. Il manquait les hypothèses et ça change tout!
Un modèle scientifique évolue au cours de l'histoire mais aussi au cours de notre apprentissage!
Lorsque je vais aborder la structure électronique, je vais par exemple utiliser le modèle planétaire de Bhor.
Même si ce modèle n'est pas conforme à l'expérience, les notions abordées seront plus faciles à comprendre par rapport au modèle probabiliste.
Votre mission est de trouver l'ion stable produit à partir de l'atome .
- Pour vous aider:
- L'ion copie la structure électronique du gaz noble dont il est le plus proche.
- Donc il a le même nombre d'électrons...
- Symboles des noyaux (gaz nobles) : 2He, 10Ne, 18Ar, 36Kr, 54Xe
Ajuster le nombre d'électrons, puis cliquer sur